Химия — это просто
- Популярно о химии
-
· Что такое химия
· Периодическая таблица - ОБЩАЯ ХИМИЯ
- Вещества и смеси
-
· Понятие вещества
· Вещество и его состояния
· Простые и сложные вещества
· Чистые вещества и смеси
· Свойства вещества
· Энергия вещества
· Газы
· Растворы
· Коллоидные растворы
· Состав растворов
· Электролитическая диссоциация
· Уравнение ионных реакций
· Степень диссоциации
· Диссоциация кислот и оснований
· Диссоциация воды
· Твердые вещества
· Неорганические вещества
· Оксиды
· Основания
· Кислоты
· Соли
· Гидролиз солей
· Электролиз - Атомы и молекулы
- Строение веществ
- Взаимодействие веществ
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- ОРГАНИЧЕСКАЯ ХИМИЯ
Понятие о рН (водородном показателе)
Вода — очень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н+ и 1 моль гидроксид-анионов ОН–. Другими словами: в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
Здесь: — равновесная концентрация ионов водорода, моль/л; — равновесная концентрация гидроксид-анионов, моль/л.
Такой раствор (среда) называется «нейтральный».
Характер среды — кислый, нейтральный — можно оценить количественно при помощи рН («пэ-аш»). Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком*:
Поэтому в случае чистой воды рН = 7.
Раствор, у которого рН = 7, называется нейтральным.
Если к чистой воде добавили кислоту, то увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например 10–6 моль/л или 10–2 моль/л.
Такая среда (раствор) называется «кислая», или «кислотная». Причём в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2) — сильнокислой, т. е. в любом случае рН < 7. Значение рН можно измерять и с большей точностью (например, рН = 5,36).
pН < 7, среда кислая.
При добавлении щёлочи увеличивается концентрация ионов ОН–, и одновременно уменьшается концентрация ионов Н+. Дело в том, что для любого водного раствора
Поэтому, если концентрация ионов ОН– составит 10–3, то = 10–11, т. е.
рН > 7, среда щелочная.
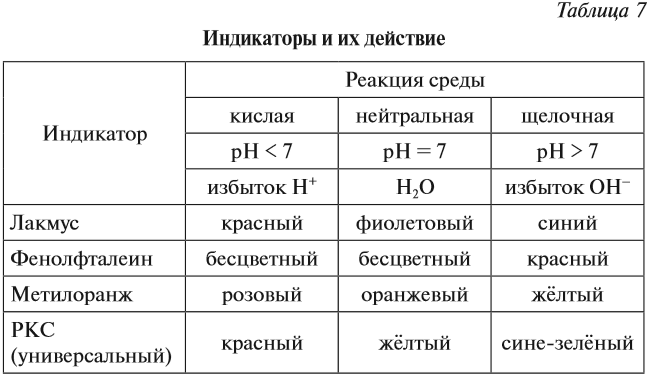
Определить реакцию среды конкретного раствора можно при помощи индикаторов.
Индикаторы — это вещества, которые изменяют свой цвет в присутствии избытка ионов Н+ или ОН–.
Ионы Н+ или ОН– действуют на молекулу индикатора, и индикатор меняет цвет по-разному в зависимости от реакции среды и вида самого индикатора (табл. 7).
Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
- рН < 7;
- = 10–4 моль/л;
- в растворе есть избыток ОН–;
- рН = 7;
- = 10–8 моль/л;
- в растворе есть НNО3;
- = 0,1 моль/л.
Окраска индикаторов изменяется в растворах, которые содержат избыток одного из этих ионов. Ионы Н+ или ОН– могут образовываться в ходе диссоциации некоторых соединений.
Вопрос. Какие вещества при диссоциации образуют ионы Н+ или ОН–?
Эти ионы могут образовываться при диссоциации растворимых кислот, оснований, некоторых кислых и основных солей. Например, дигидрофосфат натрия образует при диссоциации ионы водорода, а гидрофосфат натрия — нет. Дело в том, что кислые соли могут диссоциировать ступенчато, если полученный на первой стадии анион соответствует сильному электролиту:
остаток слабого электролита → диссоциация не идёт;
остаток сильного электролита → диссоциация идёт:
Образуются ионы Н+, возникает кислая среда.
Кроме того, ионы Н+ или ОН– могут образовываться в ходе взаимодействия некоторых веществ с водой. Например, с водой могут взаимодействовать активные металлы, кислотные и основные оксиды.
Задание 6.11. Какую окраску будет иметь индикатор лакмус, если в воде растворить: кальций, оксид лития, оксид серы (IV)?

Теория электролитической диссоциации
 Теория, основоположником которой явился Сванте Аррениус в период 1883—1887 гг., базируется на идее, что при попадании молекул растворимого вещества (электролита) в полярную или неполярную жидкость происходит их диссоциация на ионы. Электролитами называются соединения, которые в растворе самопроизвольно распадаются на ионы, способные к самостоятельному существованию. Количество образующихся ионов, их строение и величина заряда зависят только от природы диссоциировавшей молекулы.
Теория, основоположником которой явился Сванте Аррениус в период 1883—1887 гг., базируется на идее, что при попадании молекул растворимого вещества (электролита) в полярную или неполярную жидкость происходит их диссоциация на ионы. Электролитами называются соединения, которые в растворе самопроизвольно распадаются на ионы, способные к самостоятельному существованию. Количество образующихся ионов, их строение и величина заряда зависят только от природы диссоциировавшей молекулы.
 Для использования теории в описании свойств растворения используется ряд допущений, а именно: предполагается, что диссоциация является неполной, ионы (их электронные оболочки) не реагируют друг с другом, а их поведение можно описать законом действующих масс в идеальных условиях. Если рассмотреть теоретическую систему, где электролит КА находится в фазовом равновесии с продуктами своей диссоциации — катионом К+ и анионом А-, то согласно закону действующих масс можно составить уравнение реакции диссоциации:
Для использования теории в описании свойств растворения используется ряд допущений, а именно: предполагается, что диссоциация является неполной, ионы (их электронные оболочки) не реагируют друг с другом, а их поведение можно описать законом действующих масс в идеальных условиях. Если рассмотреть теоретическую систему, где электролит КА находится в фазовом равновесии с продуктами своей диссоциации — катионом К+ и анионом А-, то согласно закону действующих масс можно составить уравнение реакции диссоциации:
KA = K+ + A- (1)
Константа равновесия, записанная, через концентрации веществ при изотермических условиях будет иметь следующее значение:
Кд = x / (2)
 В этом случае (в уравнении 2), константа равновесия Кд, будет являться не чем иным, как константой диссоциации, значения , , в правой части — это равновесные концентрации электролита и его продуктов диссоциации.
В этом случае (в уравнении 2), константа равновесия Кд, будет являться не чем иным, как константой диссоциации, значения , , в правой части — это равновесные концентрации электролита и его продуктов диссоциации.
Учитывая допущение теории Аррениуса, которые были применены автором, в частности, о неполноте диссоциации, вводится понятие степени диссоциации — α. Таким образом, если выразить концентрацию раствора С (моль/л), то на литр раствора приходится αС моль электролита (КА), а равновесная его концентрация может быть выражена, как (1-α)С моль/л. Из уравнения реакции (1) очевидно, что на αС моль электролита (КА) образуется такое же количество ионов К+ и А-. Если подставить все эти величины в уравнение (2) и провести ряд упрощений, то получим формулу константы диссоциации (степень диссоциации формула):
Кд = ∝ 2 x С /1-∝ (3)
 Это уравнение позволяет количественно определить величину степени электролитической диссоциации в разных растворах.
Это уравнение позволяет количественно определить величину степени электролитической диссоциации в разных растворах.
Теория Аррениуса дала развитие множеству научных направлений в химии: с её помощью были созданы первые теории кислот и оснований, были даны объяснения физико-химическим процессам в гомогенных системах. Тем не менее, она не лишена недостатков, которые в основном относятся к тому факту, что теория не учитывает межионные взаимодействия.
Классификация электролитов с примерами
Электролиты классифицируют на слабые и сильные, периодически выделяя группу электролитов средней силы. Сильные электролиты характеризуются тем, что распадаются в растворе полностью. Как правило — это сильные минеральные кислоты, например:
- Азотная кислота — HNO3.
- Хлороводородная кислота — HCl.
- Хлорная кислота — HClO4.
- Ортофосфорная кислота — H3PO4.
Сильными электролитами могут быть основания, например:
- Гидроксид натрия — NaOH.
- Гидроксид калия — KOH.
Основная масса сильных электролитов — это подавляющее большинство солей (NaCl, Na2SO4, Ca (NO3)2, CH3COONa, хлориды, сульфиды).
Слабые электролиты, напротив, в растворах гидратируют частично. К этой группе следует относить неорганические кислоты (H2CO3, H3BO3, H3AsO4), слабые основания (аммоний), некоторые соли (HgCl2), органические кислоты (CH3COOH, C6H5COOH), фенолы и амины. В неводных растворах одни и те же соединения могут являться и сильными и слабыми электролитами, таким образом, зависят от природы растворителя.
Электролитическая диссоциация — что это в химии, теория
С давних времен люди обращали внимание на способность некоторых растворов проводить электрический ток. Этим свойством обладают не все растворы
Например, раствор поваренной соли в воде является отличным электропроводником; растворы уксусной кислоты, как и растворы углекислого и сернистого газов, проводят ток немного хуже. А растворы спирта, сахара и ряда прочих веществ не проводят ток вовсе.
М. Фарадей в XIX веке (30-е годы) изучал эти процессы. Он ввел термин «электролит», в значение которого вложил понятие о веществе, способном к электропроводности в растворенном или расплавленном виде. Его авторству принадлежат также термины «катион», «анион», «ион», «электролиз».
Однако о том, что именно ионы являются причиной проводимости, стало известно гораздо позже. Тогда считали, что молекулы распадаются на частицы вследствие воздействия электрического тока, после чего эти частицы приобретают электрический заряд.
В 1887 году Сванте Аррениус (шведский ученый) выдвинул гипотезу, что в растворе молекулы распадаются на ионы, которые притягиваются и двигаются к двум разноименно заряженным электродам — катоду и аноду. По его мнению, в этом заключалась причина появления электропроводности у растворов.
С. Аррениус был сторонником физической теории растворов. Он считал, что в растворе содержатся ионы в свободном виде. Не мог согласиться с Аррениусом Д.И.Менделеев. По его «химической» теории растворов, в них происходят химические реакции, в которых задействованы растворенные вещества и растворители. А в 1889 году Менделеев написал «Заметку о диссоциации растворенных веществ», где высказывал сомнения о протекании процессов распада электролитов в растворах.
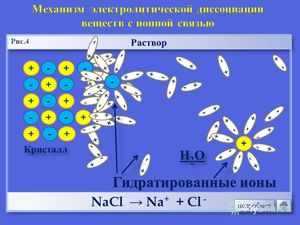
Согласно современным представлениям при растворении вещества диссоциируют, т.е. распадаются на ионы. При этом также протекает процесс гидратации — взаимодействия ионов с водой, в результате которого образуются ассоциаты ионов с молекулами (гидратированные ионы).
В случае веществ с ионной кристаллической решеткой, например, , вещество в исходном состоянии уже содержит ионы. В процессе растворения они в результате взаимодействия с водой переходят в раствор и гидратируются.
Аналогичные процессы протекают в растворах, к примеру, серной кислоты.
Водородный показатель
Определение, сущность и значение
Процессы диссоциации могут протекать не только для растворенных веществ, но и растворителя. Так, вода является сама со себе слабым электролитом и для неё характерна диссоциация в очень незначительной степени. Уравнение процесса можно записать следующим образом:
Н2О= Н3О+ + ОН-
Одна молекула воды диссоциирует на положительно заряженные ионы водорода и отрицательно заряженные анионы гидроксония. Именно концентрация этих ионов определяет уровень кислотности раствора — чем больше ионов гидроксония, тем более кислый раствор.
Концентрация ионов гидроксония в реальных растворах, как правило, очень мала (например: 5×10−6 г/л) и поэтому для удобства, это значение логарифмируют, а чтобы получить положительное значение, берут с обратным знаком. Кратко сформулируем строгое определение понятия «водородный показатель» или рН.
рН (водородный показатель) — это отрицательный натуральный логарифм концентрации ионов гидроксония, отражающий кислотность раствора.
рН= lg
Значения водородного показателя принято оценивать по шкале значений от 0 до 14, где 0 — наиболее кислый раствор, а 14 — наиболее щелочной. Нейтральным раствором (соответствующим рН чистой воды) считается раствор со значением 7. Для примера приводим несколько типичных растворов, имеющих характерные значения водородного показателя:
| Значение рН | Раствор |
| 11 | Нашатырный спирт |
| 9,5 | Гидроксид кальция |
| 8,0 | 30% раствор поваренной соли |
| 7,4 | Плазма крови |
| 7,0 | Деионизированная вода |
| 6,5 | Молоко |
| 5,5 | Кофе |
| 2,8 | Уксус (раствор 5% концентрации) |
| 0,1 | Хлорная кислота (65%) |
Значительно реже прибегают к использованию еще одного показателя — рОН. По своему смыслу он абсолютно аналогичен водородному показателю, за исключением того, что за основу берётся концентрация гидроксил-ионов.
Термическая диссоциация
Термическая диссоциация — явление, встречающееся, в частности, в газообразных веществах, которые при нагревании могут подвергаться частичному молекулярному расщеплению. Явление заключается в том, что эти вещества расширяются больше, чем соответствует повышению температуры: следовательно, их молекулярная масса , вычисленная на основе измерений плотности газа , оказывается ниже ожидаемой или величины, полученной другими способами. Диссоциация молекул (или ионов) обычно не полная и усиливается с повышением температуры и понижением давления. Поскольку это равновесная реакция, ее можно определить как константу диссоциации, так и степень диссоциации.
Принципы диссоциации
В основе принципов диссоциации лежит ионная теория, согласно которой химические соединения в растворах присутствуют в виде отдельных ионов. Это означает, что электролитическая диссоциация происходит в силу присутствия свободных ионов, которые образуются в результате разделения молекул вещества на положительные и отрицательные ионы.
Процесс диссоциации может быть обратимым или необратимым. В случае обратимой диссоциации ионы, образующиеся в процессе разложения соединения, могут снова сливаться и образовывать молекулы. В необратимом случае ионы остаются отдельными и не могут снова образовать молекулу.
Примером диссоциации является диссоциация солей в растворах. Например, хлорид натрия (NaCl) диссоциирует в растворе на натриевые (Na+) и хлоридные (Cl-) ионы. Этот процесс происходит в результате притяжения молекул растворителя к ионам и их разделения под действием сил взаимодействия между молекулами вещества и молекулами растворителя.
Таким образом, принципы диссоциации основаны на ионной теории и включают разложение химического соединения на ионы или радикалы под воздействием внешних условий. Это явление играет важную роль в химии и обеспечивает понимание поведения электролитов в растворах.
Электролитическая диссоциация
В ходе электролитической диссоциации, молекулы вещества разделяются на ионы положительного и отрицательного зарядов. Ионы с положительным зарядом называются катионами, а с отрицательным – анионами. Диссоциация может происходить только в некоторых веществах, которые обладают достаточно большой связью между ионами.
Например, рассмотрим диссоциацию кухонной соли (NaCl) в воде. Под действием электрического поля, молекула NaCl разделяется на ионы Na+ и Cl-. Таким образом, ион натрия Na+ является катионом, а ион хлора Cl- – анионом. Оба иона обладают электрическим зарядом и способны проводить электрический ток.
Электролитическая диссоциация играет важную роль в химии и имеет множество практических применений. Она позволяет проводить электролиз, производить электрохимические реакции и создавать различные виды электролитов, которые используются в батареях, аккумуляторах, электролитических конденсаторах и других электрохимических устройствах.
Молекулярная диссоциация
Примером молекулярной диссоциации является диссоциация кислот. Когда кислота растворяется в воде, ее молекулы разлагаются на ионы водорода (H+) и анионы кислоты. Например, при диссоциации хлороводородной кислоты (HCl) в воде, образуются ионы H+ и Cl-.
| Исходные молекулы | Ионы после диссоциации |
|---|---|
| HCl | H+ + Cl— |
Другим примером молекулярной диссоциации является разложение гидроксида натрия (NaOH) при нагревании. Причина диссоциации заключается в том, что при нагревании слабо стабильные связи в составляющих молекуле атомах слабеют и разрываются, образуя ионы натрия (Na+) и гидроксила (OH-).
| Исходные молекулы | Ионы после диссоциации |
|---|---|
| NaOH | Na+ + OH— |
Молекулярная диссоциация является важным процессом в химии, поскольку она может приводить к образованию ионной решетки в твердых веществах, а также определять химические свойства растворов и газов. Понимание молекулярной диссоциации позволяет более точно описывать и объяснять химические реакции и взаимодействия молекул.
Ионизационная диссоциация
Растворение вещества в воде проводится благодаря взаимодействию молекул вещества с молекулами воды. При гидратации молекулы вещества могут разложиться на ионы положительного и отрицательного заряда, которые разделяются и образуют электролитическую систему.
Примером ионизационной диссоциации является диссоциация кислоты, например, соляной кислоты (HCl). При растворении соляной кислоты в воде, молекулы HCl расщепляются на ионы H+ и Cl-. Ион H+ является положительным, а ион Cl- – отрицательным заряженными ионами. Таким образом, раствор соляной кислоты становится электролитом, способным проводить электрический ток.
Важно отметить, что ионизационная диссоциация может происходить не только в воде, но и в других растворителях. Также она может быть обратимой или необратимой, в зависимости от условий реакции
Факторы, определяющие силу кислот
Зная выражения констант диссоциации конкретных кислот, можно сделать несколько верных предположений:
- Сила анаэробной кислоты возрастает по мере увеличения атомного номера элемента, связанного с атомом водорода.
- Сила анаэробной кислоты падает по мере увеличения электроотрицательности элемента, присоединенного к атому водорода. Это может ввести в заблуждение из-за того, что теоретически увеличение электроотрицательности должно способствовать отщеплению протонов.
- Размер аниона, образующегося во время диссоциации, влияет на константу диссоциации в большей степени, чем электроотрицательность.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый С. Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяков- ский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т. е. «одетые в шубку» из молекул воды.
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104,5°, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
Как правило, легче всего диссоциируют вещества с ионной связью и, соответственно, с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой:
1) ориентация молекул (диполей) воды около ионов кристалла;
2) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
3) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с помощью следующего уравнения:
Аналогично диссоциируют и электролиты, в молекулах которых ковалентная связь (например, молекулы хлороводорода HCl, смотри ниже); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную; последовательность процессов, происходящих при этом, будет такой:
1) ориентация молекул воды вокруг полюсов молекул электролита;
2) гидратация (взаимодействие) молекул воды с молекулами электролита;
3) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
4) диссоциация (распад) молекул электролита на гидратированные ионы.
Схема электролитической диссоциации хлорида натрия на гидратированные ионы
Упрощенно процесс диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Ассоциация в растворах происходит параллельно с диссоциацией, поэтому в уравнениях реакций ставят знак обратимости.
Схема электролитической диссоциации полярной молекулы хлороводорода на гидратированные ионы
Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди Cu2+ — белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды Cu2+ • nH2O. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Диссоциация электролитов и непрерывность электролитической диссоциации
Непрерывность электролитической диссоциации означает, что процесс диссоциации происходит непрерывно при сохранении равновесия в растворе. Диссоциация электролита продолжается до тех пор, пока все молекулы электролита не разделятся на ионы. При достижении состояния равновесия концентрация ионов в растворе становится постоянной и зависит от свойств ионов и условий растворения.
В процессе электролитической диссоциации обычно участвуют различные ионы. В случае кислоты происходит диссоциация на ионы водорода (H+) и соответствующие отрицательные ионы. Для щелочей характерно образование ионов гидроксида (OH-) и соответствующих положительных ионов. Кроме того, электролиты могут образовывать ионы других веществ.
Диссоциация кислот и оснований — закон действия масс
Сильной кислотой называется кислота, которая в водном растворе показывает далеко продвинутую диссоциацию, а слабой кислотой — та, которая диссоциирует незначительно. При сравнении силы различных кислот необходимо также учитывать несколько факторов, например, склонность молекул кислоты к отдаванию протонов или тоже концентрацию рассматриваемого вещества. Однако существует химическая величина, которая не зависит от концентрации, но прекрасно характеризует индивидуальные свойства молекул —- константа диссоциации. Вывод уравнения для этой величины следует начать с составления уравнения диссоциации кислоты. Для однопротонного примера HX это будет выглядеть следующим образом:
Если раствор разбавлен и кислота слабая, то может быть применим закон действия масс, выраженный уравнением:
Возможны два способа усечения показанной зависимости. Первый шаг — принять концентрацию воды за константу. Символ co также можно опустить, так как он выражает стандартную концентрацию со значением 1 моль/дм3
Однако важно включить его в исходную формулу и учесть при определении единицы измерения. Это связано с тем, что химические константы являются безразмерными величинами
В отличие от этого, все концентрации, используемые в формуле, имеют единицу моль/дм3. В конечном итоге, таким образом, мы получаем формулу для константы диссоциации:
Отношения, выражающие константу диссоциации кислоты (Ka), являются экспериментально определенными величинами в пределах от 10-10 до 108. Обычно формулу используют в логарифмической форме, как отрицательный логарифм константы диссоциации, обозначаемый как pKa:
pKa = -logKa
Важным фактом является то, что если низкие значения Ka соответствуют слабым кислотам, а высокие — сильным, то для pKa все меняется противоположным образом. Малые, обычно отрицательные значения pKa, соответствуют сильным кислотам. Напротив, положительные, большие значения pKa — слабым кислотам. Введя еще одно понятие — степень диссоциации (α), которая обозначает отношение числа молей молекул данного химического соединения, подвергающихся диссоциации (распадающихся на ионы), к общему числу молей этого соединения, присутствующих в рассматриваемом растворе, уравнение можно развить дальше. Пренебрегая очень низкой концентрацией ионов водорода, образующихся при диссоциации воды, и используя равновесные концентрации ионов и молекул, можно предположить, что:
Тогда константу диссоциации можно записать как:
В таком виде это зависимость степени диссоциации электролита от его концентрации, т.е. закон разбавления Оствальда. При рассмотрении очень слабых электролитов степень диссоциации α можно принять равной <<1, и формула упрощается до вида:
В случае кислот, содержащих в своей структуре более одного протона, имеет место многоступенчатая диссоциация, и необходимо рассмотреть все ее стадии. Например, для получения ортофосфорной кислоты существует три стадии:
- H3PO4 + H2O = H2PO4— + H3O+
- H2PO4— + H2O = HPO42- + H3O+
- HPO42- + H2O = PO43- + H3O+
Каждая стадия имеет свою константу равновесия, которую можно расписать аналогично первой стадии:

Константы диссоциации являются стабилизироваными значениями, как для анаэробных, так и для аэробных кислот.
| Кислота | Ka | pKa |
| HF | 6,3·10-4 | 3,2 |
| HCl | 1·107 | -7 |
| HNO3 | 27,54 | -1,44 |
| H3PO4 | 6,9·10-3 | 2,16 |
Таблица 1. Примеры значений константы диссоциации для кислот.
Процесс установления равновесия оснований при диссоциации аналогичен. Если взять пример основания B, то уравнение можно записать в виде:
Затем, желая вывести константу диссоциации основания, используя закон действия масс и предполагая, что концентрация воды в разбавленном растворе практически постоянна, получаем:
Чем сильнее основание, тем выше константа диссоциации и ниже значение pKb, а чем слабее основание, тем ниже константа диссоциации и выше значение pKb.
| Основание | Kb | pKb |
| Гидразин | 3·10-6 | 5,5 |
| Аммиак | 1,78·10-5 | 4,75 |
| Метиламин | 5,0·10-4 | 3,3 |
Таблица 2. Примеры значений констант диссоциации для оснований.