Если есть этиловый спирт, зачем нужен метиловый?
Без метанола современная промышленность была бы невозможна. Краски, лаки, фанера, ДСП, пластмассы, пенопласт, реагенты для дорог, сухое горючее, антисептики, автомобильные шины. Это только основной список. Потому что следом нужно написать ещё более длинный список и перечислить в нём производства, в которых все эти компоненты задействованы. А это практически все направления промышленности. Этиловый спирт существенно дороже в производстве, чем технический спирт. Поэтому нужен метанол.
Стремительно завоевывает рынки новая технология MtO (Methanol to olefins) – позволяющая получать олефины (в первую очередь этилен и пропилен) напрямую из метанола. Согласно отчету «Рынок метанола: текущая ситуация и перспективы», который опубликовал исследовательский центр E&Y в октябре 2020 года, MtO-пластики – самое динамично растущее потребление метанола в мире (прирост доли рынка на 45% к 2025 году), на втором месте по динамике – использование метанола в качестве и в составе топлива (прирост доли рынка на 20% к 2025 году).
Производство топлива евро стандарта, его ещё часто обозначают приставкой – эко, стало возможно только благодаря метанолу. Почему «эко»? — метанол чище сгорает, полностью растворяется в воде, при этом КПД двигателей внутреннего сгорания при его применении повышается
Его называют альтернативой нефти.
Как отмечает Валерий Петухов, доктор технических наук, профессор, руководитель департамента природно-технических систем и техносферной безопасности ДВФУ, «когда мы говорим о метаноле, важно помнить, что речь идет о чистой энергии, производство которой экономически выгодно. Это новая энергетика, которая совмещает в себе два важных качества: относительно дешёвое производство, и безопасность для окружающей среды».
Уже существуют суда, работающие только на метаноле
Кстати, крупнейший в мире производитель метанола – канадская Methanex Corporation – доставляет клиентам метанол с помощью 29 морских танкеров, из которых почти половина использует метанол же в качестве топлива.
Промышленное получение
Метод синтеза метанола из оксида углерода(||) и водорода был разработан в г. компанией «Badische Anilin und Soda Fabrik (BASF)».
Синтез ― газ (смесь СО и водорода) для синтеза метанола получают в результате конверсии (риформинга) углеводородного сырья: природного газа, коксового газа, жидких углеводородов (нефти, мазута) и твёрдого топлива (угля, сланцев). Исходный газ для синтеза метанола можно получить почти из всех видов сырья, которые используют при получении водорода для синтеза аммиака. Кроме того, в обеих технологических схемах используются схожие процессы и аппараты, поэтому производство метанола часто комбинируют с производством аммиака. Примером такого смешанного производства являются ОАО «Метафракс Кемикалс» (Пермский край, город Губаха), ОАО «Невинномысский Азот» (Ставропольский край, город Невинномысск) и НПО «Азот» (город Новомосковск).
Синтез метанола протекает по гетерокаталитической реакции, которая обратимая, экзотермическая, протекающая в газовой фазе с уменьшением объёма:
СО + Н2 СН₃ОН + 90,8 кДж
СО2 + 3Н2 СН₃ОН + Н2О — 49,6 кДж
Согласно принципа Ле-Шателье равновесие реакции можно сместить в сторону выхода продукта при повышении давления и понижении температуры. Но при низких температурах скорость реакции небольшая, поэтому необходимо нагревание реакционной смеси до температуры начала химической реакции синтеза. Синтез метанола осуществляют в присутствии катализаторов на основе оксида цинка и оксида меди. Поскольку катализаторы теряют свою активность при наличии в сырье сернистых соединений, то сырьё подвергают сероочистке. Применение цинк-медных катализаторов позволяет осуществлять процесс синтеза метанола при низких температурах (250—300 °С) и низком давлении (5-10 мПа). При синтезе метанола протекают побочные реакции, которые обуславливают бесполезный расход синтез — газа и удорожают очистку метанола.
Стадии получения метанола по технологии «Компании Imperial Chemical Industries (ICI)»:
- сероочистка природного газа;
- паровая конверсия (риформинг) природного газа и водяного пара (температура 932 °С, давление 1,87 мПа, катализатор ― никельсодержащий) с получением синтез ― газа;
- синтез метанола (температура 240—270 °С, давление 8 мПа, катализатор ― медьсодержащий) с образованием метанола ― сырца, с массовой долей (метанола 84―86 %);
- ректификация метанола-сырца (отгонка легких фракций, основная ректификация) с получением готового продукта метанола-ректификата.
Химические свойства
1. Реакции замещения. Наиболее характерными для ал-канов являются реакции свободнорадикального замещения, в ходе которых атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
СН4 + С12 —> СН3Сl + HCl
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
СН3Сl + С12 —> HCl + СН2Сl2
дихлорметан хлористый метилен
СН2Сl2 + Сl2 —> HCl + CHCl3
трихлорметан хлороформ
СНСl3 + Сl2 —> HCl + ССl4
тетрахлорметан четыреххлористый углерод
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). При пропускании алканов над катализатором (Pt, Ni, А1203, Сг2O3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена:
СН3—СН3 —> СН2=СН2 + Н2
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнора-дикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива.
СН4 + 2O2 —> С02 + 2Н2O + 880кДж
В общем виде реакцию горения алканов можно записать следующим образом:

Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества. При нагревании до температуры 1500 °С возможно образование ацетилена.
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом: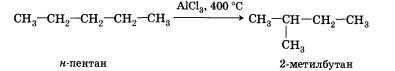
5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных: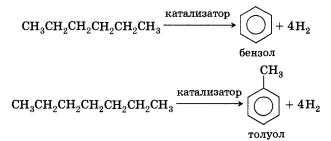
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод—углерод) связей и слабополярных С—Н (углерод—водород) связей. В них нет участков с повышенной и пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних воздействий (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, так как связи в молекулах алканов не разрываются по гетеролитическому механизму.
Наиболее характерными реакциями алканов являются реакции свободнорадикального замещения. В ходе этих реакций атом водорода замещается на атом галогена или какую-либо группу.
Кинетику и механизм свободнорадикальных цепных реакций, т. е. реакций, протекающих под действием свободных радикалов — частиц, имеющих неспаренные электроны, — изучал замечательный русский химик Н. Н. Семенов. Именно за эти исследования ему была присуждена Нобелевская премия по химии.
Обычно механизм реакции свободнорадикального замещения представляют тремя основными стадиями:
1. Инициирование (зарождение цепи, образование свободных радикалов под действием источника энергии — ультрафиолетового света, нагревания).
2. Развитие цепи (цепь последовательных взаимодействий свободных радикалов и неактивных молекул, в результате которых образуются новые радикалы и новые молекулы).
3. Обрыв цепи (объединение свободных радикалов в неактивные молекулы (рекомбинация), «гибель» радикалов, прекращение развития цепи реакций).
Использование — метиловый спирт
Использование метилового спирта в качестве среды для реакции щелочного гидролиза гексахлорбензола требует применения высоких давлений ( 10 — 15 атм), что в известной мере усложняет оборудование. Поэтому в качестве среды для реакции более целесообразно использовать спирты с высокой температурой кипения. Для этих целей могли бы быть применены высшие одноатомные спирты, как апример изоамиловый и другие. В связи с этим более приемлемыми являются многоатомные спирты, например этиленгликоль ( температура кипения 197 С) — Применение этиленгликоля позволяет вести процесс при невысоком или даже атмосферном давлении. Достоинство этиленгликоля заключается также в его почти полной инертности по отношению к щелочам даже при температуре 160 — 165 С.
Преимуществами использования метилового спирта являются его доступность, значительно меньшая стоимость, меньший расход, а Также несколько большая скорость этерификации, чем при использовании бутилового спирта. К недостаткам относятся лету честь, высокая токсичность и необходимость применения корро-зионностойких материалов, так как процесс проводится в присутствии серной кислоты.
Преимуществами использования метилового спирта являются его доступность, значительно меньшая стоимость и более низкий расход.
Йри использовании метилового спирта и продуктов, в состав которых входит метиловый спирт, принимают особые меры предосторожности.
При использовании метилового спирта необходимо помнить, что он очень ядовит. Несколько граммов этого спирта, попавшего в организм, приводят к слепоте, а несколько большее количество — — к смертельному исходу.
При использовании метилового спирта необходимо помнить, что он очень ядовит. Несколько граммов этого спирта, попавшего в организм, приводят к слепоте, а несколько большее количество — к смертельному исходу.
При использовании метилового спирта и продуктов, в состав которых входит метиловый спирт, принимают особые меры предосторожности.
По мнению Дюмануа, использование метилового спирта как горючего не представляет никаких технических трудностей.
|
Схема переработки летучих продуктов окисления пропана и бутана. |
На рис. 90 показаны важнейшие возможности использования метилового спирта.
Так, полиметакрилаты, полученные с использованием метилового спирта, не растворимы в нефтепродуктах и представляют собой широко известное органическое стекло. При синтезе мономера с использованием бутиловых спиртов полученные полимеры слабо растворимы в нефтепродуктах и растворимы в некоторых синтетических маслах.
Авторы нашли, что отделение NaBr от NaCI возможно только при использовании метилового спирта ( 99 — 100 %) в качестве растворителя.
|
Схема процесса азеотропной ректификации с регенерацией разделяющего агента путем экстракции. |
По описанной схеме производится разделение смесей близкокипящих ароматических и парафиновых углеводородов с использованием метилового спирта в качестве разделяющего агента. Приведенные схемы, являющиеся типичными для процессов азеотропной ректификации, не охватывают всего многообразия возможных схем. Выбор рациональной схемы производится с учетом свойств системы, подвергаемой разделению.
При всех перерывах в работе или отлучках лиц, работающих с метиловым спиртом в течение рабочего дня, должны приниматься меры, исключающие возможность использования метилового спирта другими лицами, посуда с метанолом должна быть убрана с рабочего места, помещение или вытяжной шкаф заперты на замок.
Промышленные растворители: источник метилового спирта
- Краски и лаки
- Различные клеи
- Дезинфицирующие средства
- Антифриз и антиобледенитель
- Автомобильные жидкости и топлива
- Некоторые виды промышленных растворителей
Промышленные растворители, такие как различные виды смол и лаков, являются основным источником метилового спирта. Они широко применяются в различных отраслях, включая химическую, красочную, строительную и автомобильную промышленности.
Метиловый спирт обладает высокими растворяющими свойствами, что позволяет использовать его в качестве экономичного и эффективного растворителя для различных веществ
Однако, стоит отметить, что его применение требует осторожности, так как он является токсичным веществом
Токсичность
Метанол — опаснейший яд, приём внутрь порядка 10 мл метанола может приводить к тяжёлому отравлению (одно из последствий — слепота), попадание в организм более 80-150 миллилитров метанола (1-2 миллилитра чистого метанола на килограмм тела) обычно смертельно. LD50 для животных — от единиц до десятка г/кг. Токсический эффект метанола развивается на протяжении нескольких часов, и эффективные антидоты способны уменьшить наносимый вред. Опасен для жизни не только чистый метанол, но и жидкости, содержащие этот яд даже в сравнительно небольшом количестве.
В США максимальное допустимое суточное употребление метанола (референтная доза), подразумевая несвязанное с какими-либо эффектами на здоровье, установлено в размере 2 мг на кг веса тела (с 1988 года).
Предельно допустимая концентрация метанола в воздухе рабочей зоны равна 15 мг/м³ (максимально-разовая) и 5 мг/м³ (среднесменная). Для сравнения, у изопропилового спирта: 10 мг/м³, у этанола — 1000 мг/м³), ПДК в воздухе населенных мест равна 1,0 мг/м³ (у изопропилового спирта 0,6 мг/м³, у этанола — 5 мг/м³. В то же время, по данным порог восприятия запаха этого вещества может достигать ~ 1600 мг/м³; и даже 7800 мг/м³.
Наиболее легкая форма отравления характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой.
Токсичность метанола состоит в том, что при попадании в организм он с течением времени окисляется до ядовитого формальдегида, который вызывает слепоту, вредно влияет на нервную систему, вступает в реакции с белками. Происходит так называемый летальный синтез.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь.
Как указано в руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки. Полезный эффект в этом случае обеспечивается отвлечением фермента АДГ I на окисление экзогенного этанола.
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление 1,2-дихлорэтаном или четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно.
Отравления метанолом довольно часты. Так, в США в течение 2013 года зафиксировано 1747 случаев.
Массовые отравления метанолом
Известно множество массовых отравлений метанолом. Источником метанола могут быть фальсифицированные незамерзающие жидкости для автомобилей, контрафактный алкоголь, метанол, выдаваемый за этиловый спирт.
- Массовое отравление метанолом в Испании в начале 1963 года; официальное число погибших 51 человек, однако существуют оценки в диапазоне от 1000 до 5000 человек.
- Массовое отравление метанолом в Бангалоре (Индия) в июле 1981 года. Число погибших — 308 человек.
- в Италии весной 1986 года; погибли 23 человека.
- Массовое отравление метанолом в Сальвадоре в октябре 2000 года вызвало смерть 122 человек. Власти подозревали теракт, поскольку в спиртных напитках на заводах-производителях метанол при расследовании инцидента не был выявлен.
- Массовое отравление метанолом 9—10 сентября 2001 года в городе Пярну (Эстония); 68 человек погибли.
- , Польше и Словакии в сентябре 2012 года; 51 человек погиб.
- Массовое отравление метанолом 17—20 декабря 2016 года в Иркутске (Россия). Число погибших — 78 человек.
- 2020 год. В мусульманском Иране, где употребление алкоголя строго запрещено законами шариата, около 300 человек умерли и более 1000 получили ущерб здоровью разной степени тяжести после того, как выпили метанола для «лечения» или «профилактики» коронавирусной болезни. Об этом со ссылкой на иранские СМИ пишет агентство Associated Press.
Применение алканов
Предельные углеводороды находят очень широкое применение в промышленности (рис. 12). Они являются доступным и достаточно дешёвым топливом, сырьём для получения большого количества важнейших соединений.
Соединения, полученные из метана, самого дешёвого углеводородного сырья, применяют для производства множества других веществ и материалов. Метан используют как источник водорода в синтезе аммиака, а также для получения синтез-газа (смесь СО и Н2), применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и других органических соединений (рис. 13).
Образование ацетилена (ценного углеводородного сырья и горючего) происходит при нагревании метана до высокой температуры:
![]()
Углеводороды более высококипящих фракций нефти используются как горючее для дизельных, турбореактивных двигателей, как основа смазочных масел, как сырьё для производства синтетических жиров и т. д.
Как вы уже знаете, углеводороды состава от С5Н12 до С11Н24 входят в бензиновую фракцию нефти и применяются в основном как горючее для двигателей внутреннего сгорания. В таких двигателях воспламенение горючего должно происходить от запальной свечи, которая даёт искру в момент наибольшего сжатия поршнем смеси газов. Однако при сжатии смеси паров бензина с воздухом углеводороды нормального строения образуют перекиси, вызывающие преждевременное воспламенение, что приводит к быстрому износу двигателя и не позволяет использовать его мощность. Это явление называют детонацией. Известно, что наиболее ценными компонентами бензина являются углеводороды с разветвлённой цепью, так как они обладают максимальной детонационной устойчивостью.
Наименьшей детонационной устойчивостью среди углеводородов бензиновой фракции обладает н-гептан.
Наиболее устойчив (т. е. в наименьшей степени образует перекиси) так называемый изооктан (2,2,4-триметилпентан):
Изооктан положен в основу условной шкалы оценки бензина по октановым числам. Ему было приписано октановое число 100, а н-гептану — 0. Октановое число 92 (например, бензин А-92) означает, что данный бензин обладает теми же детонационными свойствами, что и смесь, состоящая из 92% изооктана и 8% н-гептана.

В заключение можно добавить, что использование высокооктанового бензина даёт возможность повысить мощность и КПД двигателя внутреннего сгорания.
![]()
1. Запишите общую формулу углеводородов гомологического ряда алканов.
2. Напишите формулы возможных изомеров гексана и назовите их по систематической номенклатуре.
3. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б и В.
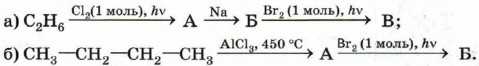
4. Приведите структурную формулу углеводорода С5Н12, образующего при бромировании только одно монобромпроизводное.
5. На полное сгорание 0,1 моль алкана неизвестного строения израсходовано 11,2 л кислорода (н. у.). Какова молекулярная формула алкана?
Ответ: С2Н6.
6. Какова структурная формула газообразного предельного углеводорода, если 7,5 г этого газа занимают объём 5,6 л (н. у.)?
Ответ: С2Н6.
7. Вспомните, что вам известно о применении метана, и объясните, почему утечка бытового газа может быть обнаружена по запаху, хотя метан и его ближайшие гомологи запаха не имеют.
8. Какие соединения могут быть получены каталитическим окислением метана в различных условиях? Напишите уравнения соответствующих реакций.
9. Продукты полного сгорания (в избытке кислорода) 10,08 л (н. у.) смеси этана и пропана пропустили через избыток известковой воды. При этом образовалось 120 г осадка. Определите объёмный состав исходной смеси.
Ответ: 3,36 л С2Н6, 6,72 л С3Н8.
10. Массовая доля углерода в соединении равна 83,3%, водорода — 16,7%. Определите строение вещества, если известно, что при его бромировании образуется только одно монобромпроизводное.
Ответ: 2,2-диметилпропан.
Изомерия и номенклатура алканов
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан.
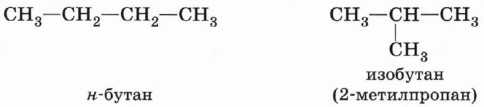
Основы номенклатуры ИЮПАК уже обсуждались. В этой части параграфа она будет более подробно рассмотрена для алканов.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является основой названия вещества.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б).
Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший заместитель (структура Г). Старшинство углеводородных заместителей определяется числом углеродных атомов. Падение старшинства, а также порядок перечисления заместителей в главной цепи соответствует ряду:
![]()
Обратите внимание, что название алкильных заместителей образуются от названия соответствующего алкана с заменой суффикса -ан на суффикс -ил. При формировании названия вначале указывают цифры — номера атомов углерода, при которых находятся заместители
Если при данном атоме находится несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил), затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана, например пропан, бутан, пентан и т. д.)
При формировании названия вначале указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находится несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил), затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана, например пропан, бутан, пентан и т. д.).
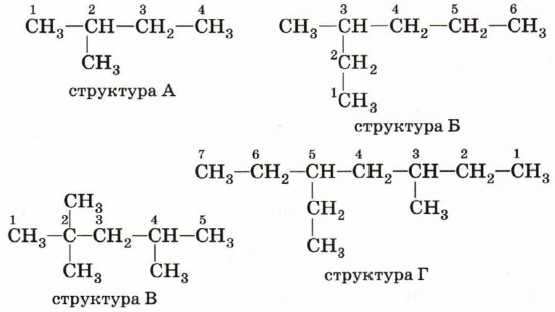
Названия веществ, структурные формулы которых приведены выше, следующие:
структура А: 2-метилбутан;
структура Б: З-метилгексан;
структура В: 2,2,4-триметилпентан;
структура Г: 3-метил-5-этилгептан.
Технология синтеза метанола и его промышленное производство
Метанол является одним из наиболее распространенных промышленных спиртов, который производится путем синтеза углекислого газа и водорода. Процесс получения метанола состоит из нескольких этапов, которые проводятся в специальном аппарате под высоким давлением и при повышенной температуре.
Первый этап – реакция газовой фазы, в которой углекислый газ и водород поступают в реактор, заполненный катализатором. В результате химической реакции образуется смесь метанола, воды и небольшого количества других продуктов.
Затем смесь охлаждается и проходит через очистительную систему для удаления нечистот, после чего еще раз охладитель до тех пор, пока метанол не станет жидким.
Далее происходит отделение метанола от остальных компонентов. Это делается при помощи дистилляции или других методов разделения. В результате получается чистый метанол высокой концентрации.
Промышленное производство метанола требует высокой точности и автоматизации всех этапов процесса. Важным моментом является подбор оптимальных условий для химической реакции, таких как давление, температура и соотношение веществ.
Существует несколько методов получения метанола, но наиболее распространенный – это каталитический синтез. Он применяется в основном из-за высокого выхода продукта и относительной простоты процесса.
Производство метанола является сложной технологией, которая требует значительных затрат энергии. Однако благодаря широкому использованию метанола в различных отраслях промышленности, таких как химическая, нефтехимическая, пластиковая и другие, его производство остается востребованным.
Углеводороды. Алканы. Строение, получение и свойства
Углеводороды — органические соединения, в состав которых входят только два элемента: углерод и водород.
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями, состав которых выражается общей формулой CnH2n+2, где n – число атомов углерода.
Алканы являются углеводородами, наиболее богатыми водородом, они насыщены им до предела. Отсюда название – насыщенные или предельные углеводороды. Их также называют парафинами. Общая черта в строении алканов и циклоалканов – простая или одинарная связь между атомами углерода.
На образование этой связи затрачивается одна пара электронов, причем максимальное перекрывание орбиталей находится на линии, соединяющей центры атомов. Такую связь называют σ-связью, а электроны, образующие её – σ-электронами.
Распределение электронной плотности σ‑ связи симметрично относительно оси, проходящей через центры связанных атомов
Все атомы углерода находятся в состоянии sp3— гибридизации, валентный угол равен 109о28’, длина связи С – С составляет 1,54 Ао. Ниже приводятся формулы и названия первых десяти членов гомологического ряда предельных углеводородов и соответсвующих им алкильных радикалов.
Гомологический ряд алканов
| Мелекулярная формула иНазвание алкана | Формула и название алкильного радикала |
| СН4 , метан | — СН3, метил |
| С2Н6, этан | — С2Н5, этил |
| С3 Н8, пропан | — С3 Н7, пропил |
| С4 Н10, бутан | — С4 Н9, бутил |
| С5 Н12, пентан | — С 5Н11, пентил (амил) |
| С6 Н14, гексан | — С6 Н13, гексил |
| С7 Н16, гептан | — С 7Н15, гептил |
| С8 Н18, октан | — С8 Н17, октил |
| С9 Н20, нонан | — С9 Н19, нонил |
| С10 Н22, декан | — С10 Н21, децил |
Для простейших алканов (С1-С4) приняты тpивиальные названия: метан, этан, пpопан, бутан, изобутан.
Начиная с пятого гомолога, названия нормальных (неpазветвленных) алканов стpоят в соответствии с числом атомов углеpода, используя гpеческие числительные и суффикс -ан: пентан, гексан, гептан, октан, нонан, декан и т.д.
В основе названия разветвленного алкана лежит название входящего в его конструкцию нормального алкана с наиболее длинной углеродной цепью. При этом углеводоpод с pазветвленной цепью pасcматpивают как пpодукт замещения атомов водоpода в ноpмальном алкане углеводоpодными pадикалами.
Напишем формулы изомеров гексана:
- СН3-СН2-СН2-СН2-СН2-СН3 — н-гексан
- СН3-СН(СН3) -СН2-СН2-СН3 СН3-СН2-СН(СН3)-СН2-СН3
- 2-метилпентан 3-метилпентан
- СН3 –С( СН3)2– СН2— СН3 СН3-СН(CH3)-СН(CH3)- СН3
- 2,2-диметилбутан 2,3 –диметилбутан
Спосoбы получения алканов:
Химические свойства алканов:
Метан используется в основном в качестве дешевого топлива. При горении он дает почти бесцветное пламя. Из метана получают ценные химические продукты: метанол, синтез-газ, формальдегид, ацетилен, различные хлорпроизводные. Этан используется при синтезе этилена.
Пропан в смеси с бутаном используется в качестве топлива. Средние члены гомологического ряда используют как горючее для двигателей (бензин, керосин), а также в качестве растворителей.
Высшие алканы – топливо для дизельных двигателей, смазочные масла и сырье для производства моющих средств.