История открытия углерода
Углерод был известен человечеству ещё с глубокой древности. Графит и уголь использовались ещё древними греками, а алмазы нашли применение в Индии. Правда, за графит частенько принимали похожие по внешнему виду соединения. Тем не менее, графит имел широкое применение в древности, в частности для письма. Даже его название происходит от греческого слова “графо” – “пишу”. Графит сейчас используется в карандашах. Алмазами начали впервые торговать в Бразилии в первой половине 18 века, с этого времени открыто множество месторождений, а в 1970 году была разработана технология получения алмазов искусственным путём. Такие искусственные алмазы применяются в промышленности, натуральные же, в свою очередь, в ювелирном деле.
приложений
Использование углерода и его соединений чрезвычайно разнообразно. Наиболее выдающийся со следующим:
Нефть и природный газ
Основное экономическое использование углерода заключается в его использовании в качестве углеводородного ископаемого топлива, такого как газообразный метан и нефть..
Масло перегоняется на нефтеперерабатывающих заводах для получения различных производных, таких как бензин, дизельное топливо, керосин, асфальт, смазочные материалы, растворители и другие, которые, в свою очередь, используются в нефтехимической промышленности, которая производит сырье для пластмасс, удобрений, фармацевтической и лакокрасочной промышленности. среди прочих.
графит
Графит используется в следующих действиях:
— Используется при изготовлении карандашей, смешанных с глинами.
— Это часть производства огнеупорных кирпичей и тиглей, термостойких.
— В различных механических устройствах, таких как шайбы, подшипники, поршни и прокладки.
— Это отличная твердая смазка.
— Из-за его электрической проводимости и его химической инертности, он используется в производстве электродов, углей электродвигателей..
— Используется в качестве модератора на атомных электростанциях.
бриллиант
Алмаз обладает особенно исключительными физическими свойствами, такими как более высокая степень твердости и теплопроводность, известные до сих пор..
Эти особенности позволяют промышленное применение в инструментах, используемых для резки и полировки инструментов для их высокой абразивности.
Его оптические свойства, такие как прозрачность и способность расщеплять белый свет и преломлять свет, дают ему множество применений в оптических приборах, например, в производстве линз и призм..
Характерная яркость, полученная из его оптических свойств, также очень ценится в ювелирной промышленности..
антрацит
Антрацит с трудом поджигается, медленно горит и требует много кислорода. Его сгорание производит небольшое пламя бледно-синего цвета и выделяет много тепла.
Несколько лет назад антрацит использовался в термоэлектростанциях и для отопления домов. Его использование имеет такие преимущества, как производство небольшого количества золы или пыли, небольшое количество дыма и медленный процесс сгорания..
Из-за высокой экономической стоимости и дефицита антрацит был заменен природным газом на термоэлектростанциях и электроэнергией в домах..
Каменный уголь
Уголь используется в качестве сырья для получения:
— Кокс, топливо из доменных печей сталелитейных заводов.
— Креозот, полученный путем смешивания смолистых дистиллятов из каменного угля и используемый в качестве защитного герметика для древесины, подверженной атмосферным воздействиям.
— Крезол (химически метилфенол) извлекают из угля и используют в качестве дезинфицирующего и антисептического средства,
— Другие производные, такие как газ, смола или смола, а также соединения, используемые в производстве парфюмерии, инсектицидов, пластмасс, красок, шин и дорожных покрытий, среди прочих.
бурый уголь
Лигнит представляет собой топливо среднего качества. Струя, разновидность лигнита, характеризуется очень компактным из-за длительного процесса карбонизации и высокого давления и используется в ювелирном деле и украшении..
торф
Торф используется в следующих видах деятельности;
— Для роста, поддержки и транспорта видов растений.
— Как органическое удобрение.
— Как постель животных в конюшнях.
— Как топливо низкого качества.
Физические свойства[править | править код]
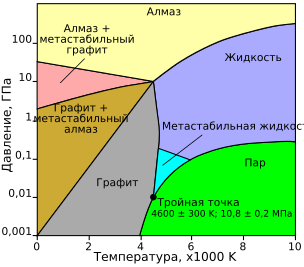
Теоретически предсказанная в 1989 году фазовая диаграмма состояния углерода. Более новая работа предсказывает, что температура плавления алмаза (верхняя правая кривая) не превышает примерно 9000 К.
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать ковалентные химические связи разного типа.
Углерод имеет самую высокую температуру сублимации среди всех известных веществ. При атмосферном давлении он не имеет точки плавления, так как его тройная точка 10,8±0,2 МПа (106,6 ± 2,0 атм) и 4600±300 К (4330±300 °C), поэтому он возгоняется при температуре около 3900 К (3630 °C).
Изотопы углерода
Природный углерод состоит из двух стабильных изотопов — 12С (98,93 %) и 13С (1,07 %) и одного радиоактивного изотопа 14С (β-излучатель, Т½ = 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота по реакции: 14N (n, p) 14C, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
На образовании и распаде 14С основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археологии.
Примечания[править | править код]
- Относительная электроотрицательность атома углерода зависит от состояния его гибридизации: Csp3 = 2,5 (в большинстве таблиц) Csp2 = 2,8 Csp1 = 3,2 (алкины)Зурабян С. Э., Колесник Ю. А., Кост А. А. и др. / под ред. Н. А. Тюкавкиной. Взаимное влияние атомов в молекуле // Органическая химия: Учебник (Учеб. лит. Для учащихся фарм. училищ). — М.: Медицина, 1989. — Т. 1. — С. 36. — 432 с. — ISBN 5-225-00314-1.
- (англ.). Дата обращения: 6 декабря 2007.
- (англ.). Дата обращения: 6 декабря 2007.
- (англ.). Дата обращения: 6 декабря 2007.
- ↑ Savvatimskiy, A (2005). «Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)». Carbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- J. H. Eggert; et al. (Nov 8, 2009). “Melting temperature of diamond at ultrahigh pressure”. Nature Physics. 6: 40—43. DOI:.
- Лейпунский О. И. Об искусственных алмазах // Успехи химии. — Российская академия наук, 1939. — Вып. 8. — С. 1519—1534.
- Seal M. The effect of surface orientation on the graphitization of diamond. // Phis. Stat. Sol., 1963, v. 3, p. 658.
- Evans T. Changes produced by High Temperature Treatment of Diamond. // The Properties of Diamond. Academi Press, 1979, p. 403—424.
- Андреев В. Д.. Спонтанная графитизация и термодеструкция алмаза при Т > 2000 K // Физика твердого тела, 1999, т. 41, вып. 4, с. 695—201.
- Togaya M. Melting behaviors of carbon underhigh pressure // High Pressure Research, 1990, v. 4, p. 342. (12 AIRAPT Conf. Proc., 1989, Padeborn).
- Андреев В. Д.. Экспериментальные данные по плавлению алмаза и графита с учётом аномальности высокотемпературной теплоёмкости // Химическая физика, 2002, т. 21, № 9, с. 3—11.
- ↑
- . РИА Новости (14 мая 2019). Дата обращения: 14 мая 2019.
- . ТАСС. Дата обращения: 14 мая 2019.
- . indicator.ru. Дата обращения: 14 мая 2019.
- V. I. Kasatochkin, A. M. Sladkov, et al., Dokl. Akad. Nauk SSSR, 177, No. 2, 358 (1967).
- Р. А. Лидин. Химические свойства неорганических веществ. — Третье. — 2004. — С. 100. — 162 с.
- Минфин РФ. minfin.ru (27 февраля 2015). — Статистические данные по добыче природных алмазов с 01.01.2003 по 31.12.2014 по результатам сортировки и первичной оценки. Дата обращения: 28 июня 2015.
Общие процессы и механизмы
Пиролиз обычно заключается в нагревании материала выше его температуры разложения, разрыв химических связей в его молекулах. Фрагменты обычно становятся более мелкими молекулами, но могут объединяться с образованием остатков с большей молекулярной массой, даже аморфных ковалентных твердых веществ.
Во многих случаях может присутствовать некоторое количество кислорода, воды или других веществ, так что сгорание, гидролиз или другие химические процессы могут происходить помимо собственно пиролиза. Иногда эти химические вещества добавляются намеренно, как при сжигании дров, при традиционном производстве древесного угля и при паровом крекинге сырой нефти.
И наоборот, исходный материал можно нагреть в вакууме или в инертной атмосфере, чтобы избежать неблагоприятных химических реакций. Пиролиз в вакууме также снижает точку кипения побочных продуктов, улучшая их извлечение.
Когда органическое вещество нагревается при повышающихся температурах в открытых контейнерах, обычно происходят следующие процессы в последовательных или перекрывающихся стадиях:
Ниже примерно 100 ° C летучие вещества, включая некоторое количество воды, испаряются. Термочувствительные вещества, такие как витамин C и белки, могут частично изменяться или разлагаться уже на этой стадии.
При температуре около 100 ° C или немного выше любые оставшаяся вода, которая просто абсорбируется материалом, удаляется. Вода, заключенная в кристаллической структуре гидратов, может отделяться при несколько более высоких температурах. Этот процесс потребляет много энергии, поэтому температура может перестать расти до завершения этой стадии.
Некоторые твердые вещества, такие как жиры, воски и сахара могут плавиться и разделяться.
Между 100 и 500 ° C многие обычные органические молекулы распадаются. Большинство сахаров начинают разлагаться при 160–180 ° C. Целлюлоза, главный компонент древесины, бумаги и хлопчатобумажных тканей, разлагается при температуре около 350 ° C
Лигнин, еще одно важное дерево компонент, начинает разлагаться примерно при 350 ° C, но продолжает выделять летучие продукты до 500 ° C. Продукты разложения обычно включают воду, моноксид углерода CO и / или диоксид углерода CO
2, а также большое количество органических соединений. Газы и летучие продукты покидают образец, и некоторые из них могут снова конденсироваться в виде дыма. Как правило, этот процесс также поглощает энергию. Некоторые летучие вещества могут воспламениться и загореться, образуя видимое пламя. Нелетучие остатки обычно становятся богаче углеродом и образуют большие неупорядоченные молекулы с цветом от коричневого до черного. На этом этапе считается, что вещество «обуглено » или «карбонизировано».
При 200–300 ° C, если не исключен кислород, углеродистый остаток может начать горят в результате сильно экзотермической реакции, часто при отсутствии или слабом видимом пламени. Как только начинается горение углерода, температура самопроизвольно повышается, превращая остаток в тлеющий уголь и выделяя диоксид и / или монооксид углерода. На этой стадии часть азота, все еще остающегося в остатке, может быть окислена до оксидов азота, таких как NO. 2 и N. 2O. 3. сера, и других элементов, таких как хлор и мышьяк могут окисляться и улетучиваться на этой стадии.
После завершения сжигания углеродистого остатка образуется порошкообразный или твердый минеральный остаток (зола ) часто остается позади, состоящий из неорганических окисленных материалов с высокой температурой плавления. Часть золы могла остаться во время горения, увлеченная газами в виде летучей золы или выбросов твердых частиц. Металлы, присутствующие в исходном веществе, обычно остаются в золе в виде оксидов или карбонатов, таких как поташ. Фосфор из таких материалов, как кость, фосфолипиды и нуклеиновые кислоты, обычно остается в виде фосфатов.
Нахождение в природе и получение[править | править код]
Руды и минералыправить | править код
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).
В организм человека углерод поступает с пищей (в норме около 300 г в сутки).
Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина)
Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоев океанических вод и др. Биологический цикл состоит в том, что углерод в виде СО2 поглощается из тропосферы растениями. Затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов — в почву и в виде СО2 — в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
Мировые ресурсыправить | править код
Каменный уголь
Общие мировые ресурсы угля, которое находилось в недрах до того, как его начали добывать, оцениваются суммарной величиной более 15 000 млрд. т. Из них примерно половина доступна для добычи.
Основная масса мировых ресурсов угля находится в Азии и сосредоточена главным образом в Китае и России. Эти страны входят в число крупнейших производителей угля. Северная Америка и Западная Европа занимают соответственно второе и третье места по ресурсам угля и являются весьма крупными производителями угля.
Производство чистого элементаправить | править код
Уголь или обычный древесный уголь — это химический элемент углерод (С). Его можно добыть при очистке недогоревших головешек из костра или купить активированный уголь в аптеке. Активированный уголь — это особым образом обработанный древесный, каменный или другой уголь, который обладает большой поглотительной, обесцвечивающей способностью. Обработка обыкновенно производится водяным и парами различных химических веществ. Регенерация активированного угля кислотами производится в зоне перегретого водяного пара. Чистый уголь применяется для поглощения различных лёгких в струе летучих газов, а также для обесцвечивания и дезодорации различных веществ и растворителей.
Методы извлечения углерода
Добыча углерода химическими методами не выгодно, поскольку гораздо дешевле и проще добывать углерод из природного угля, мировой ежегодная добыча которого составляет около 2 миллиардов тонн. Остановимся более подробно на добыче различных аллотропных модификаций углерода.
Алмаз. При температуре +1500 ° С и давлении 65 000 атмосфер в смеси графита и жидкого катализатора (железа или никеля) образуются искусственные алмазы. Таким образом за десять минут можно получить около 20 граммов мелких алмазов. По другой методике добывают алмазы действием на ту же смесь графита и катализатора взрывной волной, в этом случае можно перевести в алмаз почти весь графит, но кристаллы добытого алмаза очень малы.
Крупные месторождения алмазов обнаружены в Якутии и Африке.
Графит. Графит обычно добывают из его месторождений, иногда бывают довольно мощными. Годовая добыча графита составляет примерно 500 тысяч тонн.
Достаточно распространенный метод извлечения графитовых изделий заданной формы. Для этого металлорганических соединение определенной формы нагревают до +500 . 800 ° С при отсутствии воздуха. Вследствие такого процесса происходит графитизация вещества.
активированный уголь. Активированный (или активное) уголь добывают нагреванием каменного или животного угля в струе водяного пара и воздуха. При этом различные примеси из угля извлекаются и происходит частичное окисление угля. После очистки от примесей на поверхности угля образуется большое количество пор, а после окисления воздухом — появляются такие структурные фрагменты, как C = O, C — OH. Вследствие такой обработки угля становится способным поглощать (адсорбировать) некоторые вещества на своей поверхности. Адсорбция — это способность вещества удерживать на своей поверхности газообразные, жидкие или твердые соединения.
Это вещество добывают сильным нагреванием каменного угля без доступа воздуха.
карбин. Карбин добывают етину (С2Н2) пи-Ролиз.
Фуллерены и нанотрубки. Фуллерены и на-нотрубкы добывают при пропускании электрического разряда между графитовыми электродами в атмосфере гелия. В зависимости от температуры, давления и наличия каталитических количеств некоторых металлов могут выходить молекулы с различным содержанием атомов углерода, начиная от С60, С70, С72, С74 и заканчивая С960 и С1020.
Литература
- Общая химия. Учебник / под ред. С. Ф. Дунаева. — М.: Academia, 2017. — 160 c.
- Общая и неорганическая химия: учебное пособие / под ред. В. В. Денисова, В. М. Таланова. — Рн/Д: Феникс, 2018. — 144 c.
- Глинка Н. Л. Общая химия: учебное пособие для СПО. — М.: КноРус, 2019. — 360 c.
- Глинка Н. Л. Общая химия: учебное пособие для вузов / под ред. А. И. Ермакова. — М.: Интеграл-Пресс, 2003. — 728 с.
- Карапетьянц М. Х. Общая и неорганическая химия: учебник / под ред. М. Х. Карапетьянц, С. И. Дракин. — М.: Ленанд, 2018. — 600 c.
- Большая Медицинская Энциклопедия (БМЭ) / под ред. Б. В. Петровского , 3-е издание — М.: Академия медицинских наук СССР, 1974 — 1989 год. — т. 23.
Где и как добывают углерод

Углерод как химический элемент содержится в природе исключительно в виде соединений. Основными экономически важными углеродными соединениями являются графит и алмаз.
Распространенность графита в природе достаточно велика. Основнымти странами, которые приуспели в добыче графита являются Китай, Индия, Бразилия и Северная Корея. Графит обычно обнаруживается в связи с кварцем, слюдой полевыми штапами в песчаниках и известняках в виде жил и линз толщиной в 1 метр. На сегодняшний день классификация графита дробится на три части: аморфный, чешуйчатый и кусковой. Аморфный графит является самым распространенным, но с самым низким качеством и самым дешевым. Этот вид графита используется для изделий с низкой стоимостью. Крупные залежи аморфного гранита имеются в Китае, Европе, Мексике и США.
Чешуйчатый графит является более редким и более качественным по сравнению с аморфным. Его извлекают из горных попод в виде пластин. Чешуйчатый графит, обычно, раза в 4 дороже чем аморфный. Основные месторождения этой разновидности находятся в Австрии, Бразилии, Канаде, Китае, Германии и на острове Мадагаскар.
Кусковой графит является самым ценным, самым редким и качественным видом природного графита. Он был найден в жилах интрузивных контактов в твердых породах. Единственное место в мире, где его добывают является Шри-Ланка.
Еще одним экономически важным углеродным соединением является алмаз. Он является редким и очень ценным аллотропом углерода. Алмазы добываются из алмазной руды, но в самой руде не каждый камень является алмазом. Россия является лидером по производству алмазов, как драгоценных камней, в мире. К сведению один карат, а он равняется 0.2 грамма, оценивается приблизительно в 90$ США.
Читайте: Бериллий как химический элемент таблицы Менделева
Химические свойства
Углерод – это химический элемент, который встречается в различных формах и имеет множество применений в промышленности и науке. Он является необходимым элементом для жизни и является основой органических соединений. В природе углерод встречается в виде графита и алмазов, а также в органических соединениях, таких как уголь, нефть и газ. Углерод очень реакционен и может образовывать множество соединений. Углерод имеет многочисленные применения в промышленности, включая производство стали, графитных изделий, термостойких материалов, твердых тел, электродов, смазок и многих других. Он также находит применение в науке, включая использование углеродных нанотрубок в электронике и использование углерода в качестве катализатора в химических процессах. Таким образом, углерод – это очень важный элемент, который имеет множество форм и свойств и найдет применение в различных областях науки и техники.
Неорганические соединения
Карбиды, карбонаты и оксиды – это неорганические соединения углерода, которые имеют широкое применение в промышленности. Например, карбид кремния используется в производстве керамики, а карбид тунгстена – в производстве твердых сплавов и резцов для обработки металлов. Карбонаты углерода, такие как известняк и мрамор, используются в строительстве и производстве цемента. Оксид углерода, также известный как угарный газ, образуется при сгорании угля и используется в производстве соды и других химических веществ
Таким образом, эти неорганические соединения углерода имеют важное значение в промышленности и других отраслях науки
Органические соединения
Органические соединения являются неотъемлемой частью нашей жизни. Они могут быть найдены во многих материалах, таких как пищевые продукты, лекарства, одежда, пластик и многое другое. Углерод является ключевым элементом в органических соединениях, и его уникальные свойства делают его важным компонентом во многих материалах и продуктах. Органические соединения могут быть твердыми, жидкими или газообразными, и они имеют множество применений в различных отраслях науки. Например, многие лекарства являются органическими соединениями, а пищевые продукты содержат органические соединения, которые дают им вкус и аромат. Кроме того, органические соединения используются в производстве пластиков, красок, косметики, парфюмерии и многих других продуктах. Таким образом, углерод и органические соединения, которые он образует, являются важными компонентами нашей жизни и имеют множество применений в различных областях науки и техники.
Применение и маркировка

Инструментальные сплавы, в которых 0,65−1,32% C, используются для изготовления различного инструмента. Для улучшения механических свойств инструментов делают закалку материала изготовления.
Из конструкционных сплавов делают детали для разного оборудования, элементы конструкций строительного и машиностроительного назначения, крепежные детали и прочее. Из конструкционной стали делается проволока углеродистая, которая используется в быту, в производстве крепежа, в строительстве, для изготовления пружин. После цементации конструкционные сплавы успешно используются в производстве деталей, подвергающихся при эксплуатации серьезному поверхностному износу и испытывающих большие динамические нагрузки.
Маркировка говорит о химическом составе сплава и о его категории. В обозначении углеродистой стали обыкновенного качества есть буквы «ст». ГОСТ оговаривает семь условных номеров марок (0−6), также указывающихся в обозначении. Степень раскисления обозначают буквы «кп», «пс», «сп», проставленные в конце маркировки. Марки высококачественных и качественных сталей обозначаются цифрами, которые указывают на содержание в сплаве C в сотых долях процента.
О том, что сплав инструментальный, можно понять по букве «У» в начале маркировки. Цифра, следующая за этой буквой, говорит о содержании C в десятых долях процента. Литера «А», если таковая присутствует в обозначении инструментальной стали, указывает на улучшенные качественные характеристики сплава.
Стали с повышенным содержанием углерода могут быть менее склонными к образованию структур малой пластичности. При воздействии структурных и сварочных напряжений металл малой пластичности может разрушиться. Этому способствует наличие в нем и его сварочном шве диффузионного водорода. Для предупреждения появления холодных трещин применяются способы, позволяющие устранить факторы, способствующие появлению таких недостатков.