Энергетическая схема образования молекулы
Задача 782.
Исходя из строения атома водорода: а) указать возможные валентные состояния и степени окисленности водорода; б) описать строение молекулы Н2 с позиций методов ВС и МО; в) обосновать невозможность образования молекулы Н3.Решение:
а) Свойства водорода определяются способностью его атомов отдавать единственный электрон и превращаться в положительно заряжённый ион . При этом проявляется особенность атома водорода, отличающая его от атомов других элементов, отсутствие промежуточных электронов между валентным электроном и ядром. Ион водорода, образующийся в результате потери атомом водорода электрона, представляет собой протон, размеры которого меньше размера катионов всех других элементов на несколько порядков. Атом водорода способен не только отдавать, но и присоединять один электрон, до полного завершения s – подуровня. При этом образуется отрицательно заряжённый ион водорода с электронной оболочкой атома гелия (+11s2). Таким образом, степень окисления водорода может иметь значения -1, 0 +1.
б) Строение молекулы Н2 с позиций метода ВС можно представить так:
H. + .H H () H
Или
Энергетическая схема образования молекулы (Н2) по методу МО:
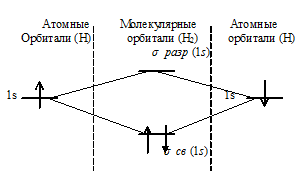
в) Энергетическая схема образования молекулы (Н3) по методу МО:
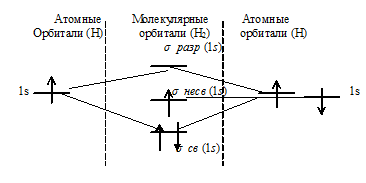
Как видно из диаграммы число связывающих электронов здесь равно 3. Порядок связи ( ) равен:
n = (3 — 0)/2 = 1,5.
Следовательно, образование Н3 будет сопровождаться выделением энергии – молекула может существовать.
Водородная связь
Задача 783.
Почему между молекулами водорода и молекулами кислорода не образуются водородные связи?Решение:
Атом водорода, соединённый с атомом сильно электроотрицательного элемента (О, F, N, и др.), способен к образованию ещё одной химической связи с другим подобным атомом. Эта связь намного слабее обычной ковалентной и называется водородной связью, обозначается тремя точками:
HF…HF
Возникновение водородной связи можно объяснить действием электростатических сил. Так при образовании полярной ковалентной связи между атомом водорода и атомом фтора, который характеризуется высокой электроотрицательностью, электронное облако, первоначально принадлежащее атому водорода, сильно смещено в сторону атома фтора. В результате атом фтора приобретает значительный эффективный отрицательный заряд, а ядро водорода (протон) с внешней по отношению к атому фтора стороны почти лишается электронного облака. Между атомом водорода одной молекулы и отрицательно заряжённым атомом фтора соседней молекулы HF возникает электростатическое притяжение, что и приводит к образованию водородной связи. Процесс образования водородной связи между двумя молекулами HF может быть представлен схемой:
Молекулы Н2 и О2 – нейтральные частицы, образованные неполярными ковалентными связями, не являются диполями, поэтому при приближении их друг к другу сил электро-статического взаимодействия не наблюдается, никаких дополнительных химических связей не образуется, наоборот, при приближении их будут наблюдаться силы отталкивания.
Задача 784.
В виде, каких ионов может входить водород в состав химических соединений?Решение:
Атом водорода имеет один электрон, который он может отдать, превратившись при этом в положительный ион – катион водорода Н+. При этом проявляется особенность атома водорода, отличающая его от атомов других элементов, отсутствие промежуточных электронов между валентным электроном и ядром атома. Ион водорода, образующийся в результате потери атомом единственного электрона, представляет собой, по сути, протон, размеры которого на несколько порядков меньше, чем размеры катионов других элементов. Поэтому поляризующее действие протона очень велико, вследствие чего водород не способен образовывать ионных соединений даже с наиболее активными неметаллами. Например, с фтором, водород образует вещество с полярной ковалентной связью. Атом водорода также способен присоединять один, недостающий до полного завершения электронного уровня, электрон. При этом образуется отрицательно заряжённый ион водорода H- с электронной конфигурацией атома гелия. В виде таких ионов водород образует ионные соединения с некоторыми металлами, например: NaH, CaH2.
Распространенность в природе
В настоящее время водород является самым распространенным элементом во Вселенной. На долю водорода приходится примерно 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля других вместе взятых элементов равна приблизительно 0,1 %). Водород представляет собой основную часть звезд и межзвездного газа.
В условиях звездных температур (к примеру, температура поверхности Солнца достигает 6000 °C) водород представлен в форме плазмы. Межзвездное пространство заполнено данным элементом в виде отдельных молекул, атомов и ионов. Вещество способно формировать молекулярные облака, которые существенно отличаются размерами, плотностью и температурой.
Массовая доля водорода в земной коре равна 1%. Данный факт позволяет водороду занимать десятое место по распространенности. Следует отметить, что значение элемента в природном мире определено не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна примерно 52%). В связи с этим, роль водорода в химических процессах, которые протекают в жизни нашей планеты, велика и сравнима по значению с кислородом.
Почти весь водород на Земле представлен в виде соединений, что отличает элемент от кислорода, присутствующего на планете и в связанном, и в свободном состояниях. Атмосфера содержит лишь незначительное количество водорода в виде простого вещества (0,00005 % по объему для сухого воздуха). Водород является компонентом почти каждого органического вещества и включен в состав всех живых клеток, где, исходя из числа атомов, на элемент приходится около 63%.
Водород 7
7 H — известный изотоп с самым высоким соотношением числа нейтронов и протонов ( N / Z = 6). Это также нуклид с наименьшим известным периодом полураспада (2,3 ± 0,6) × 10 -27 с . Он распадается на тритий 3 H и четыре нейтрона.
Впервые он был синтезирован в 2003 году группой российских, японских и французских ученых из RIKEN путем бомбардировки водорода атомами . По этой реакции шесть нейтронов гелия 8 передаются ядру водорода. Это два оставшихся протона, которые были обнаружены телескопом RIKEN, устройством, состоящим из нескольких слоев датчиков, расположенных между целью и радиусом RI циклотрона.
Реальность существования водорода 7, хотя и весьма мимолетного, была подтверждена в 2007 году наблюдением ядерного резонанса. Этот эксперимент был проведен в GANIL , Франция, путем бомбардировки мишени из через углерод 13 , в результате чего был получен пучок атомов , некоторые из которых прореагировали с углеродом 12 окружающего газа ( бутан C 4 H 10) по реакции 8 2Он + 12 6C → 7 1H + 13 7НЕТ.
Изотопы водорода
Наиболее распространенный изотоп водорода называется просто водородом или порой легче распознается как водород-1. Его ядро состоит только из одного протона и не имеет нейтронов. Этот изотоп является наиболее стабильным и распространенным в природе.
Еще одним изотопом водорода является дейтерий. Его ядро содержит один протон и один нейтрон. Дейтерий несколько тяжелее обычного водорода и обладает специфическими свойствами. Он широко используется в ядерной энергетике и других научных и технических областях.
Тритий — третий изотоп водорода, который содержит один протон и два нейтрона. Он является радиоактивным и образуется в результате ядерных реакций. Тритий также используется в ядерных реакторах и в качестве источника радиоактивных излучений в различных приложениях.
Изотопы водорода имеют различные свойства и применения. Их изучение является важным для различных научных и технических областей, а также позволяет лучше понять свойства и поведение водорода в различных условиях.
Описание обычного водорода
Водород также является самым обычным химическим элементом во Вселенной, составляя около 75% массы видимого материала. Он обычно находится в соединении с другими элементами, такими как кислород в воде (H2O) или углерод в углеводородах.
Обычный водород имеет множество применений в различных отраслях, включая производство аммиака для удобрений, использование водородных топливных элементов в энергетике и применение в процессе гидрогенизации в химическом производстве. Он также используется в ракетно-космической промышленности в качестве ракетного топлива.
Хотя обычный водород встречается повсюду, он может быть опасен при некорректном обращении с ним. В сжатом или жидком состоянии водород обладает высокой воспламеняемостью
Необходимо соблюдать осторожность при работе с ним в нехорошо проветриваемых помещениях, чтобы избежать взрывоопасных ситуаций
| Свойство | Значение |
|---|---|
| Периодический номер | 1 |
| Атомный номер | 1 |
| Относительная атомная масса | 1.00784 |
| Символ элемента | H |
Изотоп дейтерий
Дейтерий отличается от обычного водорода более высокой массой и стабильностью ядра. Из-за наличия нейтрона дейтерий имеет большую массу и может образовывать химические связи с другими атомами.
Дейтерий широко используется в научных исследованиях и в промышленности. Он используется в ядерной энергетике, производстве тяжёлой воды, в медицинской диагностике и других областях.
Изотоп тритий
Изотоп тритий обладает рядом уникальных свойств, которые находят применение в различных областях науки и техники. Он является одной из основных компонент водородной бомбы и используется в ядерных реакторах.
Тритий также широко применяется в ядерной медицине, в частности, в диагностике и терапии определенных заболеваний. Благодаря своей радиоактивности, тритий может быть использован в качестве маркера для изучения проникновения различных веществ в организм.
В природе тритий встречается в экстремально низких концентрациях, образуяся в атмосфере под действием космического излучения. Однако в силу своей радиоактивности, тритий может быть получен искусственным путем радиохимических процессов.
Учитывая радиоактивный характер трития, его использование должно осуществляться с предельной осторожностью и в строгом соответствии с правилами безопасности
Таблица изотопов
| Символ | Z | НЕТ | Атомная масса ( u ) | Период полураспада | Режим (ы) распада | Изотоп (ы) -сын | Ядерный спин | Типичный изотопный состав ( мольная доля ) | Диапазон естественной вариации ( мольная доля ) |
|---|---|---|---|---|---|---|---|---|---|
| 0.11 H | 0,113 | ||||||||
| 1 час | 1 | 1,00782503207 (10) | Стабильный | 1 ⁄ 2 + | 0,999885 (70) | 0,999816–0,999974 | |||
| 2 часа | 1 | 1 | 2,0141017778 (4) | Стабильный | 1 + | 0,000115 (70) | 0,000026–0,000184 | ||
| 3 ч | 1 | 2 | 3,0160492777 (25) | 12.32 (2) года | 3 Он | 1 ⁄ 2 + | След | ||
| 4 часа | 1 | 3 | 4,02781 (11) | 1,39 (10) × 10 -22 с | нет | 3 ч | 2 — | ||
| 4.1 H | 2 | 2 | 4,116 | ||||||
| 5 часов | 1 | 4 | 5,03531 (11) | > 9,1 × 10 -22 с ? | нет | 4 часа | ( 1 ⁄ 2 + ) | ||
| 6 часов | 1 | 5 | 6.04494 (28) | 2,90 (70) × 10 -22 с | 3n | 3 ч | 2 — # | ||
| 4n | 2 часа | ||||||||
| 7 утра | 1 | 6 | 7.05275 (108) # | 2,3 (6) × 10 -27 с # # | 4n | 3 ч | 1/2 + # |
- Стабильные изотопы в жире.
- Более 6,6 × 10 33 года. Смотрите распад протона .
- 1 H и 3 He — единственные стабильные изотопы, у которых протонов больше, чем нейтронов.
- Образуются в процессе первичного нуклеосинтеза .
- В водородном баллоне содержится 2 Наименьшее H, чем 3,2 × 10 -5 (молярная доля).
- Произведено во время первичного нуклеосинтеза , но более первично, потому что все атомы, произведенные таким образом, распались на 3 He.
- Космогенный изотоп .
Замечания
- Значения, отмеченные знаком #, получены не только из экспериментальных данных, но, по крайней мере, частично, из систематических тенденций. Спины со слабыми аргументами присваивания указаны в скобках.
- Погрешности кратко указаны в скобках после соответствующего десятичного знака. Значения неопределенности обозначают одно стандартное отклонение, за исключением изотопного состава и стандартной атомной массы ИЮПАК, в которых используются расширенные неопределенности.
Химические свойства[]
Молекулы водорода Н2 довольно прочны, и
для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
- Н2 = 2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
- Ca + Н2 = СаН2
и с единственным неметаллом — фтором, образуя фтороводород:
- F2 + H2 = 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
- О2 + 2Н2 = 2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
- CuO + Н2 = Cu + Н2O
Записанное уравнение отражает восстановительные свойства водорода.
- N2 + 3H2 → 2NH3
С галогенами образует галогеноводороды:
- F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
- Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
- C + 2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
- 2Na + H2 → 2NaH
- Ca + H2 → CaH2
- Mg + H2 → MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
- CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Оксиды восстанавливаются до металлов:
- CuO + H2 → Cu + H2O
- Fe2O3 + 3H2 → 2Fe + 3H2O
- WO3 + 3H2 → W + 3H2O
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы навзывают реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
R−CH=CH−R′+H2→R−CH2−CH2−R′{\displaystyle \mathsf{R\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!R’+H_2}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\!CH_2\!\!-\!\!R’}}
Важность изучения изотопов водорода
Изучение изотопов водорода позволяет нам лучше понять физические, химические и биологические процессы, которые происходят в природе. Каждый изотоп имеет свои уникальные свойства и может быть использован во многих областях науки и технологии.
Например, дейтерий используется в ядерных реакциях и является основным компонентом воды тяжелой. Тритий, самый редкий изотоп водорода, используется в ядерной энергетике и в процессе синтеза новых элементов. Он также является ключевым компонентом водородной бомбы.
Изотопы водорода также используются в медицинских исследованиях, сельском хозяйстве, астрономии и других областях. Они могут быть использованы для трассировки химических процессов, диагностики заболеваний, а также для изучения состава и происхождения космических объектов.
Изучение изотопов водорода подразумевает не только исследование их физических и химических свойств, но и разработку новых методов и технологий для их применения. Кроме того, они могут помочь нам более эффективно использовать и сохранять энергию, а также решать проблемы окружающей среды.
В целом, изучение изотопов водорода открывает новые горизонты для научных исследований и помогает нам лучше понять мир, в котором мы живем.
Распространенность водорода
Как уже говорилось выше водород является самым распространенным веществом во вселенной. Из этого газа состоят на 85% звезды и в межзвездном пространстве его тоже немало. Водород играет огромную роль в формировании процессов жизнедеятельности на планете Земля. На самой планете чистого водорода не много, по отношению массы к другим газам. Но если смотреть по числу молекул находящихся в соединениях можно отметить, что он занимает почетное второе место после атомов кислорода O2. Если смотреть в процентном соотношении, то на его долю приходится около 17% всех молекул. Водород присутствует практически во всех органичечких веществах и органических клетках. Чем можно отметить, что водород является таким же важным компонентом нашей жизни как и кислород.
Водород-2 (дейтерий)
Атом дейтерия содержит один протон, один нейтрон и один электрон.
2ЧАС (атомная масса 2.01410177811(12) Да), другой стабильный изотоп водорода, известен как дейтерий и содержит в своем ядре один протон и один нейтрон. Ядро дейтерия называется дейтроном. Дейтерий составляет 0,0026–0,0184% (по численности населения, а не по массе) образцов водорода на Земле, причем меньшее количество обычно обнаруживается в образцах газообразного водорода, а более высокое обогащение (0,015% или 150 частей на миллион) типично для океанской воды. Дейтерий на Земле был обогащен в отношении его начальной концентрации в Большом взрыве и внешней части Солнечной системы (около 27 ppm, по атомной доле) и его концентрации в более старых частях галактики Млечный Путь (около 23 ppm). Предположительно, разная концентрация дейтерия во внутренней части Солнечной системы связана с более низкой летучестью газа и соединений дейтерия, обогащающих фракции дейтерия в кометах и планетах, подвергшихся значительному воздействию солнечного тепла на протяжении миллиардов лет эволюции Солнечной системы.
Дейтерий не радиоактивен и не представляет значительной опасности токсичности. Вода, обогащенная молекулами, в состав которых входит дейтерий вместо протия, называется тяжелая вода. Дейтерий и его соединения используются в качестве нерадиоактивной метки в химических экспериментах и в растворителях для 1ЧАС-ЯМР-спектроскопия. Тяжелая вода используется как замедлитель нейтронов и теплоноситель для ядерных реакторов. Дейтерий также является потенциальным топливом для коммерческих термоядерная реакция.
Меры предосторожности с водородам
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объему. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако, следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации. Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
Положение элемента в Периодической системе химических элементов Д. И. Менделеева, строение атома
Водород, состоящий из одного протона и одного электрона, располагается в первом периоде таблицы. Строение атома водорода обусловливает уникальные свойства элемента. Электронная конфигурация атома водорода — 1 s1. Возможные степени окисления:
| Cтепень окисления | Примеры соединений |
|---|---|
| -1 | NaH, CaH2 |
| H2 | |
| +1 | HCl, H2O H2SO4 |
У водорода имеется три изотопа. Самый легкий из них — протий 11H, является наиболее распространенным в природе. Тяжелый изотоп 12H (дейтерий) обозначается D. Третий изотоп, радиоактивный тритий 13H, обозначается T.
Обычный, тяжелый и сверхтяжелый водород, тяжелая вода
Тяжелый водород содержится в природном водороде в небольших количествах, 1 атом тяжелого водорода на 5.000 атомов обычного. По аналогии с протоном ядро дейтерия получило название дейтон, или дейтерон. Обозначают дейтерий латинской буквой D, либо сохраняют химическое обозначение H и цифрой 2 указывают его массовое число — Н2. Дейтерию свойственно иное строение ядра, чем обычному водороду. Наличие в ядре кроме протона еще и нейтрона обуславливает вдвое большую массу атома дейтерия, чем атома обычного водорода. Такое расхождение в массах изотопов одного и того же химического элемента является уникальным среди известных изотопов различных элементов.
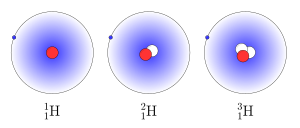
Изотопы водорода
Тяжелая вода — это вода, в которой протий заменен дейтерием. Её свойства радикально отличаются от свойств обычной воды. Обычная вода замерзает при 0 °С, тяжелая при +3,8 °C; температура кипения обычной воды 100 °C, а тяжелой 101,4 °C. Плотность тяжелой воды 1,1056 г/см3, и в ней невозможна жизнь живых существ.
В обычной воде всегда содержится некоторая примесь тяжелой, обычно в пределах 0,02 % по массе. Тяжелая вода замедляет нейтроны, что позволяет использовать её в качестве замедлителя в ядерных реакторах. Получают тяжелую воду путем электролиза (разложения электрическим током) обычной воды, при этом в первую очередь разлагаются молекулы обыкновенной воды, с накоплением тяжелой в остатке.
Стоимость получаемой электролизом тяжелой воды все еще высока, один её кубометр обходится в не менее чем 300 тыс. долларов США. Самый сверхтяжелый изотоп водорода тритий получается искусственным путем в результате ядерных реакций, при «стрельбе» нейтронами в атомы лития. Ядра трития состоят из двух нейтронов и одного протона. Трития в природе очень мало, один атом трития приходится на 1018 атомов обычного водорода. Тритий радиоактивен, его период полураспада составляет 12,5 лет, при распаде он излучает β-частицы с превращением в изотоп гелия с атомным весом 3.
Сравнительно недавно появилось извещение об обнаружении итальянскими физиками нового изотопа водорода с атомным весом 4. Время существования этого изотопа составляет около 10−11 секунды.
Помимо обычных двухатомных молекул водорода, предполагается возможность получения трехатомной молекулы гизония. Если гизоний когда-нибудь будет получен, он может оказаться настолько же недолговечным, что и «сверхтяжелейший» водород.
Распространение изотопов водорода
Вода состоит из атомов водорода и кислорода, но существуют различные формы воды, в которых атомы водорода имеют различные изотопы. В природе преобладает водород в форме обычного атома, также называемого протия (H). Однако, существует также два других изотопа водорода: дейтерий (D), который содержит один нейтрон, и тритий (T), в котором атом содержит два нейтрона.
Содержание изотопов водорода в природе имеет свои особенности. Так, протий является наиболее распространенным изотопом водорода и составляет около 99,985% от общего числа атомов водорода на Земле. Изотоп дейтерия (D) составляет около 0,015% от общего числа атомов водорода, а тритий (T) является самым редким и составляет менее чем 0,00000001% от общего числа атомов водорода.
Изотопы водорода широко распространены в природе и встречаются в различных естественных источниках. Например, обычный водород можно найти в воде, пищевых продуктах, топливе и других органических веществах. Дейтерий, в свою очередь, содержится в морской воде, льдах, снеге, а тритий в природе образуется в результате ядерных реакций и редко встречается в больших количествах. Тритий, например, можно найти в атмосфере и при исследованиях ядерной энергетики.
Распространение изотопов водорода уникально и их различная концентрация отражает процессы, происходящие в природной среде. Изучение изотопного состава водорода позволяет ученым изучать различные геохимические процессы, а также прослеживать генезис веществ, в которых содержится водород. Кроме того, изотопный состав водорода играет важную роль в палеоклиматологии и археологии, помогая восстановить климатические условия далекого прошлого и исследовать археологические находки.