Число — нуклон
Число нуклонов в ядре А N — — Z называется массовым числом. Нуклонам ( протону и нейтрону) приписывается массовое число, равное единице, электрону нулевое значение А.
Число нуклонов в ядре определяет атомный вес, а число протонов — атомный номер. Обе характеристики очень важны: атомный вес — в ядерной физике, а атомный номер — в химии.
Число нуклонов А в ядре не столь велико, чтобы можно было без оговорок использовать методы статистич. Гиббса распределения), успешно применяемой в физике конденсир. Успехи, достигнутые в решении задачи 3 — 4 тел гл. Ситуация осложняется недостаточной определенностью наших знаний о ядерных силах. Наконец, установление составной природы нуклонов превращает систему А нуклонов в систему, по крайней мере, 3 / 4 кварков, что еще более усложняет задачу описания структуры и свойств ядер. Последовательное решение этой задачи может быть достигнуто только в рамках ( непсртурбативной) квантовой хромодинамики, но она еще далека от разрешения.
Число нуклонов в ядре определяется целым массовым числом А. Как видно из фиг. За исключением А — 5 8, 43 и 61, все значения А от 1 до 209 представлены известными устойчивыми ядрами, существующими в природе. Ядра с одинаковыми Z, но разными А, называются изотопами. Поскольку изотопы являются разными сортами одного и того же элемента, они обладают одинаковыми химическими свойствами и, следовательно, не могут быть разделены химическими методами. Примерное содержание различных изотопов в данном элементе может быть определено либо из сверхтонкой структуры полосатых спектров, либо при помощи, масс-спектрографа.
Число нуклонов в ядре A N Z называется массовым числом. Нуклонам ( протону и нейтрону) приписывается массовое число, равное единице, электрону — нулевое значение А.
Определить число нуклонов, которые могут находиться в ядре на наинизшем квантовом уровне.
Увеличим число нуклонов еще на три порядка.
Изотопы, число нуклонов которых кратно 4, дважды магические.
Закон сохранения числа нуклонов, сформулированный в предыдущем параграфе — пс является законом сохранения массы в упомянутых реакциях, потому что точный подсчет суммы масс исходных и получившихся продуктсз обнаруживает некий дефект массы — разность масс, за счет которой выделяется соответствующая энергия. Этот дефект массы в зависимости от характера реакции может быть положительным или отрицательным.
Закон сохранения числа нуклонов, сформулированный в предыдущем параграфе, не является законом сохранения массы в упомянутых реакциях, потому что точный подсчет суммы масс исходных и получившихся продуктов обнаруживает некий дефект массы — разницу масс, за счет которой выделяется соответствующее количество энергии. Этот дефект массы в зависимости от характера реакции может быть положительным или отрицательным.
При увеличении числа нуклонов в ядре Е1 изменяется, но не монотонно.
Поскольку вдвое увеличивается число нуклонов.
МАССОВОЕ ЧИСЛО — число нуклонов в атомном ядре; обозначается А и указывается индексом справа вверху рядом с символом изотопа: напр.
Массовое число определяет число нуклонов ( сумму нейтронов и протонов) в ядре, а порядковый номер — число протонов в ядре. Например, ядро атома фтора обозначается так: ЦР. Это означает, что ядро фтора состоит из 9 протонов и 19 — 9 10 нейтронов.
Каково может быть число нуклонов, если конечное состояние системы равновесное.
Каким образом рассчитывается нуклонное число
Нуклонное число — это сумма протонов и нейтронов в ядре атома. Для рассчета нуклонного числа необходимо знать количество протонов и нейтронов в ядре.
Существует несколько способов вычисления нуклонного числа:
- Изотопическая нотация: в этом случае нуклонное число указывается прямо после символа химического элемента. Например, водород-1 или H-1 имеет нуклонное число 1.
- Символьная нотация: в этом случае нуклонное число записывается как верхний индекс справа от символа химического элемента. Например, ^{1}_{1}H имеет нуклонное число 1.
- Изотопическая и символьная нотации можно комбинировать для указания нуклонного числа и заряда атома. Например, {1}^{+}_{1}H имеет нуклонное число 1 и заряд +1.
Также нуклонное число можно вычислить, зная массовое число и заряд атома. Массовое число представляет собой сумму протонов и нейтронов в ядре. Заряд атома равен количеству протонов. Нуклонное число можно получить, вычтя заряд атома из массового числа.
| Массовое число | Заряд атома | Нуклонное число |
|---|---|---|
| 4 | 2 | 2 |
| 16 | 8 | 8 |
| 23 | 11 | 12 |
В таблице приведены примеры вычисления нуклонного числа на основе массового числа и заряда атома.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
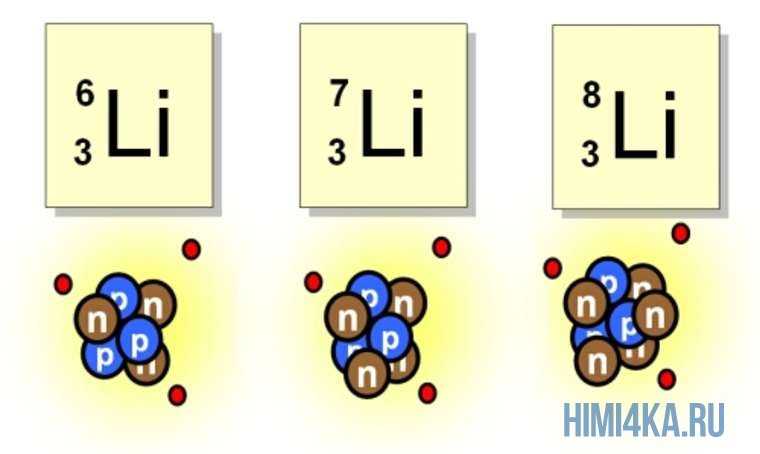
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
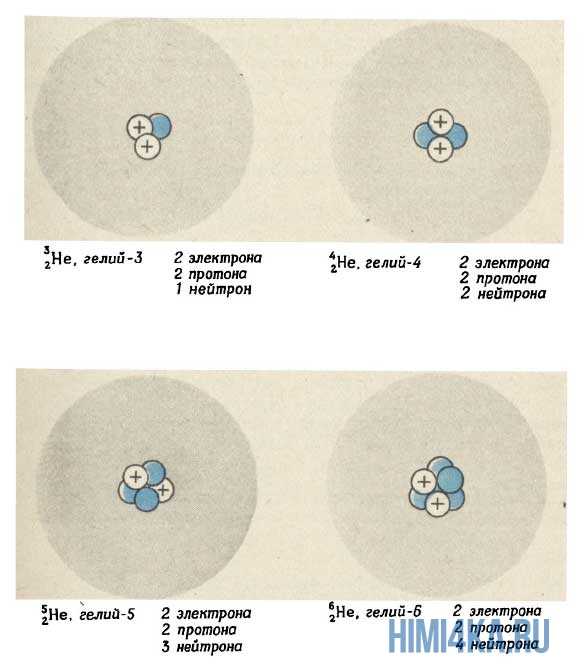
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Примеры использования нуклонного числа
Нуклонное число — это важная физическая величина, используемая в химии для определения состава и свойств атомного ядра.
Следующие примеры демонстрируют использование нуклонного числа в различных аспектах химии:
-
Определение изотопов
Нуклонное число позволяет определить изотопы элементов. Изотопы — это атомы одного и того же элемента, у которых количество нейтронов в ядре отличается. Например, углерод имеет три главных изотопа: углерод-12, углерод-13 и углерод-14. Нуклонное число каждого из них равно 12, 13 и 14 соответственно.
-
Расчет атомной массы
Нуклонное число используется для расчета атомной массы элемента. Атомная масса — средневзвешенное значение массы атомов изотопов элемента, учитывающее их относительную обилие. Например, атомная масса углерода равна приблизительно 12.01, что означает, что больше частиц углерода имеют нуклонное число 12, но есть и некоторое количество частиц с нуклонным числом 13 и 14.
-
Предсказание стабильности ядер
Нуклонное число позволяет предсказать стабильность ядер элементов. Стабильные ядра имеют оптимальное соотношение количества протонов и нейтронов в ядре. Используя нуклонное число, можно определить, какие ядра вероятно будут стабильными, а какие будут нестабильными и распадаться с течением времени.
-
Исследование ядерной физики и реакций
Нуклонное число является основой для исследования ядерной физики и реакций. Изучение изменений нуклонного числа и распадов ядер позволяет нам понять основные принципы ядерных реакций, таких как деление ядра или синтез новых ядерных элементов.
Эти примеры демонстрируют важность нуклонного числа в понимании структуры, свойств и реакций атомных ядер. Химики, физики и другие ученые активно используют это понятие для расширения наших знаний о мире вокруг нас
Протонно-нейтронная модель ядра
Протонно-нейтронная модель гласит, что ядра состоят из двух видов элементарных частиц — протонов и нейтронов. Число протонов в ядре равно числу электронов в атомной оболочке, потому что в целом атом электрически нейтрален, а заряд протона равен модулю заряда электрона. Получается, что число протонов в ядре равно атомному номеру элемента Z в периодической таблице элементов Д. И. Менделеева.
Массовое число – это сумма числа протонов Z и числа нейтронов N в ядре, обозначается буквой А:
Массы протона и нейтрона приблизительно равны атомной единице массы, они близки друг другу.
Ядерная физика отличается частицами маленьких параметров, поэтому за единицу массы принимают 1/12 часть массы атома углерода: 1 а. е. м. = 1,661 * 10-27 кг. Следовательно масса нейтрона mn = 1,008665 а. е. м., а масса протона mp = 1,007276 а. е. м.
Масса ядра атома намного больше суммарной массы электронов в нём. Следовательно, массовое число ядра равно округлённой до целого числа относительной атомной массе элемента.
Нуклоны – это протоны и нейтроны, составляющие ядро атома.
n — символ нейтрона; его заряд равен нулю, а относительная масса — примерно единице; р — символ протона; его заряд равен единице, относительная масса также равна примерно единице.
Для обозначения ядер применяется символ
, где X — символ химического элемента, А — массовое число, Z — атомный номер (зарядовое число, или число протонов).
Радиус ядра можно определить по формуле r ~ 1,3 * 10-13 А 1/3 см. Следовательно, объём ядра прямо пропорционален корню кубическому из массового числа (числа нуклонов в ядре).
Сейчас учёные выделяют более 1500 ядер, которые различаются и зарядовым, и массовым числами либо одним из них.
Изотопы — это ядра с одним и тем же значением Z (числом протонов), но с различными массовым и числами А (с различным числом N нейтронов).
Ядра делятся на устойчивые и распадающиеся (радиоактивные). Изотопы одного и того же элемента могут различаться в этой характеристике.
На устойчивость ядер указывает значение отношения числа нейтронов к числу протонов в ядре (N /Z). У лёгких ядер (А <30) это отношение составляет примерно единицу. Большие значения массового числа обозначают содержания большого количества нейтронов, а не протонов в стабильном ядре. Увеличение числа протонов приводит к возрастанию кулоновского отталкивания, чему характерно возрастание числа нейтронов, обеспечивающего лишь силу притяжения.
Если Z превышает 82, то стабильные ядра не могут существовать, ведь кулоновское отталкивание слишком велико.
Базовая модель атома и атомная теория
Все вещества состоят из частиц, называемых атомами. Атомы связываются друг с другом, образуя элементы, и содержат только один вид атома.
Атомы различных элементов образуют соединения, молекулы и объекты.
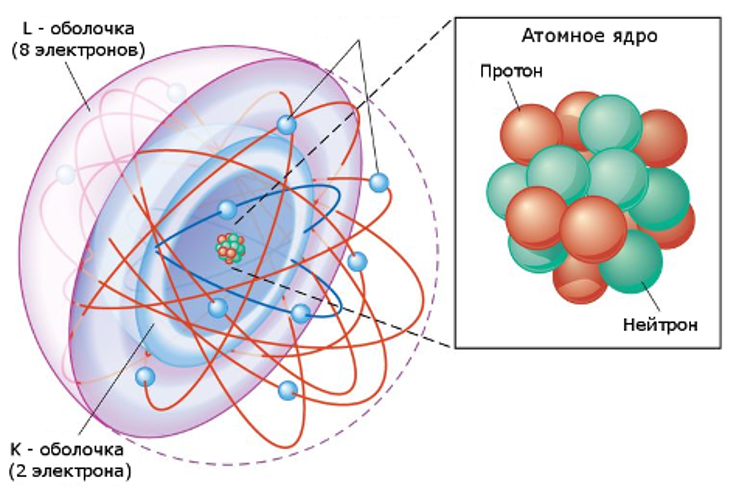
Атом — это строительный блок материи, который нельзя разбить на части с помощью каких-либо химических средств.
Ядерные реакции могут изменить атомы.
Три части атома — это протоны (положительно заряженные), нейтроны (нейтральный заряд) и электроны (отрицательно заряженные).
Протоны и нейтроны образуют атомное ядро.
Электроны притягиваются к протонам в ядре, но движутся так быстро, что падают к нему (орбите), а не прилипают к протонам.
Идентичность атома определяется его числом протонов. Это также называется его атомным номером.
Части Атома
Атомы состоят из трех частей:
Протоны: протоны являются основой атомов. В то время как атом может получать или терять нейтроны и электроны, его идентичность связана с числом протонов. Символом числа протонов является заглавная буква Z.
Нейтроны: число нейтронов в атоме обозначается буквой N. Атомная масса атома является суммой его протонов и нейтронов или Z + N. Сильная ядерная сила связывает протоны и нейтроны вместе, образуя ядро атом.
Электроны: электроны намного меньше протонов или нейтронов и вращаются вокруг них.
Основные характеристики атомов:
Атомы не могут быть разделены с помощью химических веществ. Они состоят из частей, которые включают протоны, нейтроны и электроны, но атом является основным химическим строительным материалом материи. Ядерные реакции, такие как радиоактивный распад и деление, могут разрушать атомы.
Каждый электрон имеет отрицательный электрический заряд.
Каждый протон имеет положительный электрический заряд. Заряд протона и электрона равен по величине, но противоположен по знаку. Электроны и протоны электрически притягиваются друг к другу. Как заряды (протоны и протоны, электроны и электроны) отталкиваются друг от друга.
Каждый нейтрон электрически нейтрален; иными словами, нейтроны не имеют заряда и не притягиваются электрически ни к электронам, ни к протонам.
Протоны и нейтроны имеют примерно одинаковые размеры и намного больше электронов. Масса протона по существу такая же, как у нейтрона.
Масса протона в 1840 (!) раз больше массы электрона.
Ядро атома содержит протоны и нейтроны. Ядро несет положительный электрический заряд.
Электроны движутся вне ядра; они организованы в оболочки, которые являются областью наиболее вероятного их местонахождения.
Простые модели показывают, что электроны вращаются вокруг ядра по почти круговой орбите, подобно планетам, вращающимся вокруг звезды, но реальное поведение намного сложнее.
Некоторые электронные оболочки напоминают сферы, но другие больше похожи на тупые колокольчики или другие формы.
Технически, электрон может быть найден в любом месте в пределах атома, но проводит большую часть своего времени в области, описываемой орбиталью.
Электроны также могут перемещаться между орбиталями.
Атомы очень маленькие. Средний размер атома составляет около 100 пикометров или одну десятитысячную часть метра.
Почти вся масса атома находится в его ядре; почти весь объем атома занят электронами.
Количество протонов (также известно как его атомный номер) определяет элемент.
Изменение количества нейтронов приводит к образованию изотопов. Изменение числа электронов приводит к образованию ионов. Изотопы и ионы атома с постоянным числом протонов — это вариации одного элемента.
Частицы внутри атома связаны друг с другом мощными силами.
В общем, электроны легче добавлять или удалять из атома, чем протон или нейтрон.
Химические реакции в основном включают атомы или группы атомов и взаимодействия между их электронами.
Как определить число нейтронов в атоме?
Очень просто!
N = A – Z
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атома или порядковый номер атома в периодической таблице Менделеева.
Развернутый ответ
Масса атома складывается из двух величин: масса протонов + масса нейтронов. Дело в том, что масса электронов пренебрежимо мала.
Масса нейтрона = 1,674 927 498 04(95)⋅10⁻²⁷ кг= 1,008 664 915 60(57) а.е.м.
Масса протона = 1,672 621 923 69(51)⋅10⁻²⁷ кг = 1,007276466621(53) а.е.м.
Масса электрона = 9,109383 7015(28)⋅10⁻³¹ кг = 0,000548579909065 а.е.м.
То есть даже 100 электронов дадут в сумме всего 0,0548579909065 а.е.м.
Первоначально Д. И. Менделеев в построении своей периодической таблицы исходил из атомных весов элементов. Однако, дальнейшее развитие науки показало, что свойства химических элементов находятся в прямой зависимости не от атомной массы химического элемента, а от заряда ядра его атома. Таким образом, в периодической таблице химические элементы выстроены в порядке возрастания заряда ядра атома и номер элемента в таблице соответствует заряду его ядра. А заряд ядра равен сумме протонов. То есть № (элемента) = Z (заряд ядра или число протонов).
Остаток массы ядра приходится на нейтроны. Поэтому чтобы определить число нейтронов в атоме нужно всего лишь вычесть из атомной массы число протонов, которое равно заряду ядра или порядковому номеру элемента в таблице Менделеева.
Сколько протонов и нейтронов в атоме натрия?
Ar (Na) = 23 а.е.м.Z (Na) = 11 (протонов)N = Ar (Na) – Z (Na) = 23 – 11 = 12 (нейтронов)Ответ: число протонов в атоме натрия равно 11, а число нейтронов в атоме натрия равно 12.
Сколько протонов и нейтронов в атоме фосфора?
Ar (P) = 31 а.е.м.Z (P) = 15 (протонов)N = Ar (P) – Z (P) = 31 – 15 = 16 (нейтронов)Ответ: число протонов в атоме фосфора равно 15, а число нейтронов в атоме фосфора равно 16.
Сколько протонов и нейтронов в атоме золота?
Ar (Au) = 197 а.е.м.Z (Au) = 79 (протонов)N = Ar (Au) – Z (Au) = 197 – 79 = 118 (нейтронов)Ответ: число протонов в атоме золота равно 79, а число нейтронов в атоме золота равно 118.
Сколько протонов и нейтронов в атоме кремния?
Ar (Si) = 28 а.е.м.Z (Si) = 14 (протонов)N = Ar (Si) – Z (Si) = 28 – 14 = 14 (нейтронов)Ответ: число протонов и нейтронов в атоме кремния равно 14.
Сколько протонов и нейтронов в атоме углерода?
Ar (C) = 12 а.е.м.Z (C) = 6 (протонов)N = Ar (C) – Z (C) = 12 – 6 = 6 (нейтронов)Ответ: число протонов и нейтронов в атоме углерода равно 6.
Сколько протонов и нейтронов в атоме калия?
Ar (K) = 39 а.е.м.Z (K) = 19 (протонов)N = Ar (K) – Z (K) = 39 – 19 = 20 (нейтронов)Ответ: число протонов в атоме калия равно 19, а число нейтронов в атоме калия равно 20.
Сколько протонов и нейтронов в атоме железа?
Ar (Fe) = 39 а.е.м.Z (Fe) = 19 (протонов)N = Ar (Fe) – Z (Fe) = 56 – 26 = 30 (нейтронов)Ответ: число протонов в атоме железа равно 19, а число нейтронов в атоме железа равно 30.
Сколько протонов и нейтронов в атоме алюминия?
Ar (Al) = 27 а.е.м.Z (Al) = 13 (протонов)N = Ar (Al) – Z (Al) = 27 – 13 = 14 (нейтронов)Ответ: число протонов в атоме алюминия равно 13, а число нейтронов в атоме алюминия равно 14 .
Сколько протонов и нейтронов в атоме фтора?
Ar (F) = 19 а.е.м.Z (F) = 9 (протонов)N = Ar (F) – Z (F) = 19 – 9 = 10 (нейтронов)Ответ: число протонов в атоме фтора равно 9, а число нейтронов в атоме фтора равно 10.
Сколько протонов и нейтронов в атоме хлора?
Ar (Cl) = 35 а.е.м.Z (Cl) = 17 (протонов)N = Ar (Cl) – Z (Cl) = 35 – 17 = 18 (нейтронов)Ответ: число протонов в атоме хлора равно 17, а число нейтронов равно 18.
Сколько протонов и нейтронов в атоме кислорода?
Ar (O) = 16 а.е.м.Z (O) = 8 (протонов)N = Ar (O) – Z (O) = 16 – 8 = 8 (нейтронов)Ответ: число протонов и нейтронов в атоме кислорода равно 8.
Сколько протонов и нейтронов в атоме серы?
Ar (S) = 32 а.е.м.Z (S) = 16 (протонов)N = Ar (S) – Z (S) = 32 – 16 = 16 (нейтронов)Ответ: число протонов и нейтронов в атоме серы равно 16.
Сколько протонов и нейтронов в атоме магния?
Ar (Mg) = 32 а.е.м.Z (Mg) = 16 (протонов)N = Ar (Mg) – Z (Mg) = 24 – 12 = 12 (нейтронов)Ответ: число протонов в атоме магния равно 16, а число нейтронов равно 12.
Сколько протонов и нейтронов в атоме цинка?
Ar (Zn) = 65 а.е.м.Z (Zn) = 30 (протонов)N = Ar (Zn) – Z (Zn) = 65 – 30 = 35 (нейтронов)Ответ: число протонов в атоме цинка равно 30, а число нейтронов в атоме цинка равно 35.
Литература[править | править код]
- М. Айзенберг, В. Грайнер. Модели ядер, коллективные и одночастичные явления. — М.: Атомиздат, 1975. — 454 c.
- М. Айзенберг, В. Грайнер. Микроскопическая теория ядра. — М.: Атомиздат, 1976. — 488 с.
- К. Бракнер Теория ядерной материи. — М., Мир, 1964. — 302 с.
- О. Бор, Б. Моттельсон. Структура атомного ядра. — В 2-х т. — М.: Мир, 1971—1977.
- В. П. Крайнов. Лекции по микроскопической теории атомного ядра. — М.: Атомиздат, 1973. — 224 с.
- В. В. Маляров. Основы терии атомного ядра. 2-ое изд. — М.: Наука, 1967. — 512 с.
- Р. Натаф. Модели ядер и ядерная спектроскопия. — М.: Мир, 1968. — 404 с.
- С. М. Поликарпов. Необычные ядра и атомы. — М.: Наука, 1977. — 152 с.
- Дж. Рейнуотер. Как возникла модель сфероидальных ядер. Успехи физических наук, 1976, Том 120. Вып. 4, с. 529—541. (Нобелевская лекция по физике 1975 г.)
- А. Г. Ситенко. Теория ядерных реакций. — М.: Энергоатомиздат, 1983. — 352 с.
- А. Г. Ситенко, В. К. Тартаковский. Лекции по теории ядра. — М.: Атомиздат, 1972. — 352 с.
- Л. Слив М. И. Стрикман, Л. Л. Франкфурт. Проблемы построения микроскопической теории ядра и квантовая хромодинамика, Успехи физических наук, 1976, Том 145. Вып. 4, с. 553—592.
- В. Г. Соловьев. Теория атомного ядра. Ядерные модели. — М.: Энергоиздат, 1981. — 296с.
- В. Г. Соловьев. Теория сложных ядр. — М.: Наука, 1971. — 560 с.
- Журнал: Физика элементарных частиц и атомного ядра (ЭЧАЯ) (Архив статей с 1970 г.)
Что такое атомное ядро — теории строения
В 1911 году британский физик Э. Резерфорд заявил об открытии, перевернувшее представления о химии не только общества философов, перед которым выступал ученый, но и всего научного мира.
В докладе «Рассеяние α- и β-лучей и строение атома» Резерфорд говорил об:
Открытие атомного ядра послужило началом для ядерной физики, изучающей свойства атомных ядер химических элементов.
Современное определение атомного ядра звучит так:
Наука воспринимает атомное ядро как физический объект с характерными для него свойствами. Теоретическое описание модели атомного ядра практически не представляется возможным из-за малого размера частиц, составляющих атом. Из-за этого появляется множество представлений о строении атомного ядра, некоторые из которых могут взаимоисключать, противоречить или дополнять друг друга.
Теории строения атомного ядра:
- Оболочечная.
Предложена Д. Д. Иваненко и Е. Н. Гапоном в 1932 году, дополнена М. Гепперт-Майер и Х. Йенесоном в 1949 году.
Модель ядра представляет собой систему протонов и нейтронов, которые движутся в усредненном поле независимо друг от друга из-за силовых воздействий от других нуклонов.
Отрицательные частицы заполняют электронные оболочки до предела, а дальше электроны продолжают присоединяться со значительным понижением энергии связи.
Теория является неполной из-за невозможности объяснения деформированных ядер.
- Капельная.
Предложена Н. Бором в 1936 году.
Согласно данной теории, ядро по форме представляет собой сферическую равномерно заряженную каплю, которая напоминает жидкость. Она обладает несжимаемостью, насыщением ядерных сил, испарением нуклонов.
Теория является макроскопической, не объясняя свойств и строение ядра на микроскопическом уровне.
- Кластерная или модель нуклонных ассоциаций.
Появление относится ко второй половине 30-х годов прошлого века.
Согласно теории, ядро представляет собой α-частичные кластера.
Теория подходит для описания некоторых легких ядер, но не пригодна для более сложных систем.
- Статистическая.
В 1936 году и в 1937 году была параллельно открыта Я. Френкелем и Л. Ландау.
Рассматривает модель атома с точки зрения уровней разного порядка, средние и тяжелые ядра на которых возбуждаются при высокой энергии, но расстояние между ними остается маленьким.
- Коллективная.
Открытие относится к 1952 году, когда О. Бор и Б. Моттельсон разработали свою систему на основе теории капельной модели строения атомного ядра.
По теории ядро образуется нуклонами заполненных электронных оболочек и окружается внешними нуклонами.
- Обобщенная Бора — Моттельсона.
Также предложена в 1952 году О. Бором и Б. Моттельсоном. Объясняла некоторые особенности поведения ядер тем, что нуклоны, образующие ядро, могут деформироваться и становиться вытянутыми или сплюснутыми.
- Сверхтекучая.
Предложена в 1958 году О. Бором и Дж. Валатином.
Согласно теории, спаривание нуклонов приводит к сверхтекучести ядерного вещества. Причина спаривания — взаимодействие частиц, которые движутся по индивидуальным орбитам.
- Ротационная.
Описывала причину сочетания вращения всего ядра с движением отдельных нуклонов. Согласно этой модели, ядро атома должно быть несферическим.
- Оптическая.
Ядро — полупрозрачная сфера, которая обладает определенным коэффициентом преломления и поглощения, а частица, попадающая в такую среду, испытывает все характерные для полупрозрачной оптической среды виды взаимодействия.
- Вибрационная.
Ядро воспринимается как жидкая капля. Используется для объяснения спектра коллективных возбуждений сферических ядер.