История открытия
Углерод был открыт в древности, исследователи до сих пор не могут точно сказать, кем и когда был сделан этот открытие. Но существуют данные, указывающие на то, что углерод был использован историческими цивилизациями еще задолго до его официального открытия.
Первая упоминания о том, что углерод был использован, появились в древних текстах древних греческих и индийских ученых. Они заметили, что некоторые вещества, такие как древесный уголь и алмазы, имеют схожие свойства и считаются различными формами углерода.
Алмазы, алмазы привлекли особенное внимание исследователей, поскольку они считаются одними из самых твердых известных материалов. В 1772 году ученый Антонио Лавуазье первым предложил термин «углерод» и провел опыт, доказывающий, что алмазы и древесный уголь являются разными формами одного и того же элемента
Позднее было открыто, что углерод также может быть представлен в виде графита, фуллерена и углеродных нанотрубок, которые обладают уникальными свойствами и применяются в различных областях науки и техники.
Сегодня углерод является одним из самых известных химических элементов и имеет огромное значение в различных отраслях, включая электронику, материаловедение, металлургию и биологию.
Опасности углерода и его соединений
Чистый углерод имеет низкую токсичность для человека, с ним можно безопасно обращаться и даже проглатывать в виде графита или древесного угля. Он устойчив к растворению или химическому воздействию, например, даже в кислой среде пищеварительного тракта.
Напротив, сероуглерод CS 2 , хотя и похож по структуре на диоксид углерода, является высокотоксичной жидкостью, используемой в качестве растворителя ( вулканизация каучука).
Другими оксидами углерода являются оксид углерода CO и менее распространенный субоксид углерода C 3 O 2 . Монооксид углерода представляет собой бесцветный, без запаха газа , образованный сгорания неполным органических соединений или чистого углерода (древесный уголь). В окиси углерода связывает сильнее , чем кислорода, то уровень гемоглобина в крови , чтобы сформировать карбоксигемоглобин, устойчивое соединение. Результатом этой реакции является отравление молекулами гемоглобина , которое может быть фатальным (см. Статью, о которой идет речь).
Цианид- ион CN — имеет химическое поведение, подобное галогенид- иону . Соли, содержащие цианид-ион, очень токсичны. Цианоген, газ состава (CN) 2, также близок к галогенам .
С металлами углерод образует карбиды C 4 или ацетилиды C 2 2 . Что бы ни случилось, при электроотрицательности 2,5 углерод предпочитает образовывать ковалентные связи . Некоторые карбиды представляют собой ковалентные решетки, такие как карбид кремния SiC, который выглядит как алмаз и, кроме того, используется для их размера.
Токсичность новых аллотропных форм углерода (фуллеренов, нанотрубок, графена) в настоящее время широко изучается. В своем естественном состоянии эти наноструктуры по-прежнему трудно фильтровать в воздухе и могут представлять опасность, которую необходимо оценить. Следует отметить, что в контексте их использования эти соединения обычно обнаруживаются диспергированными в растворителе или фиксированными на твердой подложке.
История открытия
Углерод использовался людьми с давних времен. Грекам был известен графит и уголь, а алмазы впервые нашлись в Индии. К слову, в качестве графита люди часто принимали схожие по виду соединения. Но даже несмотря на это, графит широко использовался для письма, ведь даже слово «графо» с греческого языка переводится как «пишу».

В настоящее время графит используется так же в письме, в частности его можно встретить в карандашах. В начале 18 века в Бразилии началась торговля алмазами, были открыты многие месторождения, а уже во второй половине 20 века люди научились получать ненатуральные драгоценные камни.
На настоящий момент ненатуральные алмазы используются в промышленности, а настоящие – в ювелирной сфере.
Простое тело
Твердое состояние
| Восемь форм углерода: алмаз , графит , лонсдейлит , бакминстерфуллерен и два других фуллерена , аморфные и углеродные нанотрубки . |
Алмаз и графит являются двумя наиболее распространенными аллотропами углерода, они различаются по внешнему виду (вверху) и их свойства. Это различие связано с их структурой (см. Ниже). |
Углерод встречается в природе в двух основных аллотропных формах :
- графит укладки кристаллических структур гексагональные и монопланарные ( графеновы ), и серого цвета. Это стабильная форма при комнатной температуре и давлении;
- алмаз , четырехгранная кристаллическая структура (структура типа « алмаз ») является прозрачным. Это стабильная форма при высокой температуре и высоком давлении, метастабильная при комнатной температуре и давлении.
В условиях нормального давления углерод находится в форме графита , в которой каждый атом связан с тремя другими атомами в слое конденсированных гексагональных колец, как в ароматических углеводородных соединениях . Благодаря делокализации орбиталей графит проводит электричество . Графит мягкий, потому что химические связи между плоскостями слабые (2% от таковых между плоскостями), и поэтому слои легко скользят относительно друг друга.
π{\ displaystyle \ pi}
Алмаз, одна из самых популярных кристаллических форм углерода.
Под очень высоким давлением углерод кристаллизуется в гранецентрированной кубической системе, называемой алмазом , в которой каждый атом связан с четырьмя другими (межатомное расстояние 136 мкм ). Алмазы через сопротивление углерод-углеродные связи , является, с нитридом бора , тем труднее материал , поцарапать. При комнатной температуре превращение в графит происходит так медленно, что его невозможно обнаружить. При определенных условиях углерод кристаллизуется в лонсдейлит , по форме похожий на алмаз, но гексагональный. Из всех драгоценных камней , то алмаз является единственным полностью израсходован.
Помимо графита (чистый sp 2 ) и алмаза (чистый sp 3 ), углерод существует в аморфной и сильно разупорядоченной форме (aC). Эти аморфные формы углерода представляют собой смесь графитоподобных участков с тремя связями или алмазоподобных участков с четырьмя связями. Для создания переменного тока используются многие методы: распыление, электронно- лучевое испарение , электродуговое напыление, лазерная абляция и т. Д. В 2019 году циклическая молекула C 18(чистый sp 1 ) был синтезирован удалением групп CO в оксиде C 24 O 6.
Углеродные нанотрубки.
Этот углеродный лук представляет собой структура , основанная на фуллерен-подобная структуру, но стенка которого состоит из нескольких слоев углерода.
Углерод цилиндрической формы называется нанотрубками (углеродная нанотрубка, сокращение: CNT). Они были обнаружены в таблетке, образующейся на катоде электрической дуги при синтезе фуллеренов. Эти объекты нанометрового диаметра и длины, иногда доходящей до миллиметра, выглядят как плоскости углерода одноатомной толщины (или графена ), свернутые на себя и образующие трубку нанометрового диаметра). Нанотрубки, стенка которых состоит только из одной плоскости углерода, называются «одностенными». Нанотрубки, полученные электродуговым методом, почти все являются «многолистными».
Графен состоит из одной плоскости углерода одноатомной толщины. Графен можно просто получить, взяв одну плоскость углерода из кристалла графита.
Вместе с этими структурами мы наблюдаем большое количество полиэдрических наночастиц . Подобно луку и многослойным нанотрубкам, наблюдения с помощью просвечивающей электронной микроскопии высокого разрешения ( (en) HRTEM : Transmission Electron Microscopy ) показывают, что эти углеродные наночастицы состоят из нескольких слоев графена, закрытых, оставляя нанометровую полость в их центр.
Жидкость и газ
Фазовая диаграмма углерода. PT = тройная точка .
При атмосферном давлении углерод (графит) будет сублимировать при 4100 K . В газообразной форме он обычно образует небольшие цепочки атомов, называемые карбинами . При очень медленном охлаждении они сливаются, образуя неровные и деформированные графитовые листы, которые образуют сажу . Среди последних мы находим, в частности, однослойную сферическую форму C 60, называемую фуллереном , или, точнее, бакминстерфуллереном , и его разновидности C n (20 ≤ n ≤ 100) , которые образуют чрезвычайно жесткие структуры.
Жидкий углерод образует только выше давления и температуры от тройной точки , и , следовательно , выше 10,8 ± 0,2 МПа (приблизительно в 100 раз атмосферное давление) и 4,600 ± 300 K .
Роль углерода в организме человека
В тело человека углерод попадает вместе с пищей, в течение суток – 300 г. А общее количество вещества в человеческом организме составляет 21% от массы тела.
Из данного элемента состоят на 2/3 мышцы и 1/3 костей. А выводится из тела газ вместе с выдыхаемым воздухом либо же с мочевиной.
Стоит отметить: без этого вещества жизнь на Земле невозможна, ведь углерод составляет связи, помогающие организму бороться с губительным влиянием окружающего мира.
Таким образом, элемент способен составлять продолжительные цепи либо же кольца атомов, которые представляют собой основу для множества других важных связей.
Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
CH3—СН=СН2 + Н2 → CH3—СН2—СН3
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
СН2=СН2+ Br2 → CH2Br-CH2Br
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Поэтому:
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
CH2=CH2 + H2O → CH3-CH2-OH
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
CnH2n + (3/2)nO2 → nCO2 + nH2O
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
3C2H4 + 2KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2 + 2KOH (охлаждение)
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 12H2O (нагревание)
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
CH3CH=CH2 + 2KMnO4 + 3H2SO4 → CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O (нагревание)
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
История открытия углерода
Углерод был известен человечеству ещё с глубокой древности. Графит и уголь использовались ещё древними греками, а алмазы нашли применение в Индии. Правда, за графит частенько принимали похожие по внешнему виду соединения. Тем не менее, графит имел широкое применение в древности, в частности для письма. Даже его название происходит от греческого слова «графо» — «пишу». Графит сейчас используется в карандашах. Алмазами начали впервые торговать в Бразилии в первой половине 18 века, с этого времени открыто множество месторождений, а в 1970 году была разработана технология получения алмазов искусственным путём. Такие искусственные алмазы применяются в промышленности, натуральные же, в свою очередь, в ювелирном деле.
Химические свойства
Углерод – это химический элемент, который встречается в различных формах и имеет множество применений в промышленности и науке. Он является необходимым элементом для жизни и является основой органических соединений. В природе углерод встречается в виде графита и алмазов, а также в органических соединениях, таких как уголь, нефть и газ. Углерод очень реакционен и может образовывать множество соединений. Углерод имеет многочисленные применения в промышленности, включая производство стали, графитных изделий, термостойких материалов, твердых тел, электродов, смазок и многих других. Он также находит применение в науке, включая использование углеродных нанотрубок в электронике и использование углерода в качестве катализатора в химических процессах. Таким образом, углерод – это очень важный элемент, который имеет множество форм и свойств и найдет применение в различных областях науки и техники.
Неорганические соединения
Карбиды, карбонаты и оксиды – это неорганические соединения углерода, которые имеют широкое применение в промышленности. Например, карбид кремния используется в производстве керамики, а карбид тунгстена – в производстве твердых сплавов и резцов для обработки металлов. Карбонаты углерода, такие как известняк и мрамор, используются в строительстве и производстве цемента. Оксид углерода, также известный как угарный газ, образуется при сгорании угля и используется в производстве соды и других химических веществ
Таким образом, эти неорганические соединения углерода имеют важное значение в промышленности и других отраслях науки
Органические соединения
Органические соединения являются неотъемлемой частью нашей жизни. Они могут быть найдены во многих материалах, таких как пищевые продукты, лекарства, одежда, пластик и многое другое. Углерод является ключевым элементом в органических соединениях, и его уникальные свойства делают его важным компонентом во многих материалах и продуктах. Органические соединения могут быть твердыми, жидкими или газообразными, и они имеют множество применений в различных отраслях науки. Например, многие лекарства являются органическими соединениями, а пищевые продукты содержат органические соединения, которые дают им вкус и аромат. Кроме того, органические соединения используются в производстве пластиков, красок, косметики, парфюмерии и многих других продуктах. Таким образом, углерод и органические соединения, которые он образует, являются важными компонентами нашей жизни и имеют множество применений в различных областях науки и техники.
Дальнейшие открытия и исследования углерода
В XX веке ученые сосредоточились на изучении особенностей углерода в различных формах. Оказалось, что углерод может образовывать различные аллотропные модификации, такие как алмаз, графит и фуллерены. Каждая из этих модификаций имеет уникальные свойства и применения.
В 1985 году был открыт графен — одноатомный слой углерода, обладающий уникальными электрическими и механическими свойствами. Это открытие стало важным прорывом в нанотехнологии и наноматериалах, открывая новые возможности для создания микроэлектронных устройств и материалов будущего.
Исследования углерода продолжаются и по сей день. Каждое новое открытие и исследование помогает лучше понять свойства этого уникального элемента и использовать его в различных сферах науки, техники, медицины и промышленности.
- Углерод был открыт в XVIII веке.
- Открытие углерода значительно расширило наше понимание о химических элементах и их роли в природе.
- Углерод является одним из наиболее распространенных элементов в природе и имеет огромное значение для жизни на Земле.
- Углерод используется во многих отраслях промышленности, включая производство пластиков, лекарств и электроники.
- Углерод имеет уникальные свойства, такие как способность образовывать длинные цепочки и образовывать связи с другими элементами, что делает его основой для образования огромного разнообразия соединений.
- Исследование углерода и его соединений продолжается, и все новые открытия в этой области вносят существенный вклад в развитие науки и технологий.
История открытия углерода
Периодическая система элементов Д. И. Менделеева
Углерод известен как уголь, копоть, сажа, алмаз, графит. В 1778 году Карлом Вильгельмом Шееле, нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется оксид углерода (IV) или углекислый газ. Химический состав алмаза был установлен в результате опытов Антуана Лорана Лавуазье в 1772 году после изучения горения алмаза на воздухе и исследований Смитсона Теннанта в1797 году, доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. Углерод как химический элемент был признан только в Антуаном Лораном Лавуазье.
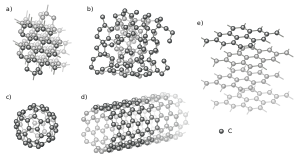
Аллотропные модификации углерода
Впервые «чистый уголь» был исследован им, как процесс сжигания в воздухе и кислороде. в 1787 году Гитоном де Морво, Антуаном Лораном Лавуазье, Клодом Луи Бертолле и Антуаном Франсуа Фуркруа было предложено название «углерода» (carbone) вместо французского «чистый уголь» (charbone pur). Первым получил свободный углерод английский химик Смитсон Теннант в 1791 году, пропуская пары фосфора над прокалённым мелом. При этом образовывался фосфат кальция и углерод. Алмаз сгорал без остатка при сильном нагревании. Процесс горения алмаза был известен с 1751 года во времена французского короля Франца Первого. После повторного сжигания алмаза с помощью зажигательной машины А. Лавуазье пришел к выводу, что алмаз — это кристаллический углерод. В алхимическом периоде графит — второй аллотроп углерода, который назвали «plumbago» и считали его видоизмененным свинцовым блеском.
В 1740 году Иоганном Генрихом Поттом было обнаружено отсутствие примеси свинца в графите. В 1779 году Карл Шееле счёл графит сернистым телом особого рода, особым минеральным углём, содержащим связанную «воздушную кислоту» — СО2 или углекислый газ. В 1760 году Гитон де Морво превратил алмаз в графит, а затем в угольную кислоту при нагревании. В начале XIX века Александром Ивановичем Шерером, Василием Михайловичем Севергиным старое слово «уголь» в русской химической литературе иногда заменялось словом «углетвор», с 1824 года Михаил Фёдорович Соловьёв ввёл название «углерод».
Углерод имеет следующие названия:
- международное — «Carboneum»;
- немецкое — «Kohlenstoff» (происходит от «Kohle» — уголь);
- древнерусское — «угорати», или «угарати» (обжигать, опалять) имеет корень гар, или гор, с возможным переходом в гол.
№4

В чистом виде он обычно находится в кристаллической форме и, таким образом, образует либо алмаз, или же образует графит. Алмаз – это самый твердый природный материал, поэтому он используется не только в качестве драгоценности, но и в качестве режущего материала. Графит – термодинамически стабильная форма элементарного углерода, находящегося в условиях нормального давления и температуры. Благодаря своей электронной проводимости он нашел широкое применение в промышленности в качестве электрода. Также его используют в качестве стержня в карандашах.
Несмотря на то, что и алмаз и графит состоят из чистого углерода (С), они имеют абсолютно разные характеристики. Алмаз прозрачный, а графит нет. Алмаз твердый (10 баллов из 10 по шкале Мооса), а графит самый мягкий (1 балл из 10 по шкале Мооса). Разница вызвана разным строением кристаллической решетки. Алмаз имеет кристаллическую решетку прочного тетраэдра, в то время как графит имеет «слоеную» решетку со слабыми связями.
История и этимология
Название « углерод» происходит от латинского карбо , carbōnis ( «уголь» ). Производство углерода в виде древесного угля путем пиролиза древесины под слоем земли было также известно римлянам. Углерод в алмазной форме известен в Азии с древних времен, он также упоминается в Ветхом Завете. Его название также происходит от римского adámas, adámantis («твердая сталь»).
Понятие углеродного элемента появляется, когда Рене Антуан Фершо де Реомюр изучает образование стали из железа , он отмечает, что это преобразование соответствует поглощению элемента железом. В 1772 году Антуан Лавуазье изучил горение угля и алмазов, он наблюдал количественное образование углекислого газа, но не обнаружил образование воды. Таким образом, он доказывает, что эти два материала полностью состоят из углерода.
Природный графит был известен с древних времен, но его природа не была понятна, поскольку его путали с молибденитом и считали разновидностью свинца . В 1779 году Карл Вильгельм Шееле также продемонстрировал окислением графита, что он в основном состоит из углерода. В 1787 году Химическая номенклатура в Луи Бернар Guyton де Морво написал статью , определяющую углерод в чистом виде углерода.
Название «углерод» появляется в словаре Французской академии в его 6- м издании (1832-5). XIX — го века является подъем углерода для производства энергии. Например, в году Антуан Сезар Беккерель опубликовал содержание углерода в основных формах топливной древесины, закупаемой в то время в Париже:
- 1 кубометр древесины твердых пород ( дуб , вяз , граб , бук и ясень ): 140 кг;
- 1 кубический метр белой древесины ( береза , осина , тополь и хвойных пород ): 87 килограммов;
- 1 кубометр древесины со связками и котелками : 122 кг.
Затем история отмечена повышенным значением углерода, например:
- 1828: открытие органических соединений и органической химии (см. Статью Фридриха Велера );
- 1842: с сопротивлением материалов , август Wöhler закладывает основы будущего « материаловедение »;
- 1985: открытие фуллеренов по Роберт Керл , Гарольд Крото и Ричард Смолли ;
- 2004: открытие графена от Андре Гейма , состоящее из одного слоя графита .