Аммиак от вредителей
Аммиак – это средство «два в одном». Он одновременно играет роль удобрения и является эффективным биоцидом, т. е. предотвращает нападение вредителей. Редкий препарат может похвастаться таким свойством.
Перечень их велик:
- муравьи;
- мошки;
- тля;
- слизни;
- гусеницы;
- капустная и луковая муха;
- проволочник;
- медведка.
Большинство этих насекомых не переносят запах аммиака в таких концентрациях, которые не ощутимы для человека. Иногда достаточно однократных обработок по листу раствором из 50 мл нашатыря и 7 л воды.
Такие опрыскивания губительны для тли, мошек, луковой мухи. Для других вредителей такая обработка будет недостаточной. Причина этого в том, что запах аммиака быстро улетучивается. Необходимо зафиксировать его на обрабатываемых поверхностях.
Для этого используют жирные кислоты, входящие в состав мыла:
- Раньше традиционно использовали раствор хозяйственного мыла. Сейчас применяют бытовые моющие средства для посуды.
- Хотя у хозяйственного мыла есть неоспоримые преимущества – оно более натуральное и не содержит агрессивных химических веществ. При обработке на плодах, которые потом идут в пищу, это имеет большое значение.
- На мелкой терке натирают 100-200 г хозяйственного мыла и растворяют его в 1 л горячей воды. Полученный раствор вливают в ведро с водой (10 л) и добавляют 100 мл аммиака. Такая смесь не хранится и используется немедленно.
- Обработка таким составом имеет преимущество перед химическими инсектицидами, потому что не проникает в растительные ткани. Им пользуются и в период образования завязи и формирования плодов.
Не любят аммиачный запах и комары. Если обработать раствором прилегающую территорию, это на какое-то время уменьшит количество кровососущих насекомых.
Для этого воду (1 л) нужно смешать со 100 мл нашатыря. Этот состав уменьшит и зуд после укусов.
Сфера применения нашатырного спирта
Нашатырный спирт незаменим в медицине. Благодаря антисептическим свойствам он используется для обработки рук врачей и медицинских инструментов.
Регенерирующее и противоотечное действие вещества обуславливает его применение для заживления ран и ссадин.
Резкий запах спирта делает его средством номер один для быстрого вывода людей из обморочного состояния. Стоит человеку вдохнуть характерный аромат, как у него тут же поднимается давление и учащается дыхание, что мгновенно приводит к возвращению сознания.
Способность нашатырного спирта при употреблении внутрь вызывать рвоту также пригождается в определённых ситуациях.
Применение дешевое аптечное средство находит и в быту. Так, его часто используют для «подкормки» домашних цветов, ведь в составе спирта присутствует аммиак. Бонусом является отпугивающих насекомых резкий запах. При этом самим растениям никакого вреда не наносится, в отличии от использования иных, более агрессивных средств от мошек.
Домохозяйкам давно известна способность нашатырного спирта справляться с выведением пятен самого разного происхождения. Так же его водный раствор используется для обновления внешнего вида золотых и серебряных украшений, очистки хрусталя, окон и зеркал, удаления налета из раковин и ванных.
Области применения
Область применения аммиака и аммиачного спирта широка, он используется практически во всех сферах жизнедеятельности человека, начиная от технологических процессов и заканчивая медициной и бытовыми нуждами.
Применение аммиака
Аммиак широко применяется в качестве хладагента в различном бытовом и промышленном оборудовании.
Он является одним из важнейших продуктов, используемых в химической промышленности. В частности, его используют в производстве:
- нашатырного спирта;
- добавок в строительные материалы для использования в морозных условиях;
- полимеров, соды и азотной кислоты;
- удобрений;
- взрывчатых веществ.
Использование аммиачного спирта
Аммиачный спирт применяется в медицине и в быту.
Применение в медицине показано в следующих случаях:

Применение в быту заключается в обезжиривании и чистки различной домашней утвари.

Раствором спирта из расчета 2 ч. л. на 2 стакана воды и 1 ст. л. любого средства для мытья посуды можно отлично почистить столовое серебро, серебряные и золотые ювелирные украшения (изделия с жемчугом нашатырным спиртом чистить нельзя, он станет серым и мутным). Для этого надо поместить в раствор столовое серебро или ювелирные изделия, подержать от 1 до 2 часов, затем прополоскать в воде и насухо вытереть.
Он хорошо выводит пятна крови, мочи и пота с шерсти, шелка и лайкры. В качестве пятновыводителя используется 50% раствор. В концентрированном виде может удалить следы от карандаша на одежде.
С ковров, мебельной обивки и автомобильных чехлов можно удалить пятка раствором из 1 ст. л. чистого аммиака и 2 л горячей воды. Для этого надо прочистить загрязнение и дать просохнуть. Если будет необходимость, то можно повторно прочистить.
Оконные стекла, зеркала и фаянс тоже можно почистить раствором из 1 ст. л. чистого аммиака и 3 ст. воды. Поверхность будет чистая и хорошо блестеть.
Спирт может использоваться в садоводстве для борьбы с луковой мухой и тлей, а также в качестве удобрения, для огородных и комнатных растений в условиях кислой почвы.
Видео
Аммиак может принимать различные состояния агрегации и, как и другие соединения может находиться либо в газообразной, либо жидкой форме. Аммиак — это жидкость с не очень приятным запахом.
Вещество, часто используется на занятиях по химии в школе, чтобы показать, что такое химические ожоги. Аммиак имеет желтый цвет, распознать его можно по характерному запаху. Если пары аммиака смешиваются с воздухом в достаточной пропорции и нужном количестве, то может произойти взрыв, и, следовательно, его доля в воздухе, после этого сильно снижается.
В настоящее время аммиак можно найти во многих местах, начиная от крупных промышленных предприятий, где он используется для холодного хранения, применение находит в медицине. После соответствующей обработки, 10% раствор аммиака — это нашатырный спирт (гидрат аммиака: NH3·H2O). Раньше, аммиак использовался в составе нюхательной соли. Мало кто, однако, знает, что он применяется в качестве компонента красок или … разрыхлителя. Как видно, в зависимости от того, в какой форме находится соединение, оно может иметь различные свойства.
Чаще всего аммиак используется в холодильных установках, холодильной промышленности, в основном из-за его термодинамических свойств. Тем не менее, аммиак может использоваться также в качестве растворителя, в частности, для растворения металлов.
Аммиак был обнаружен в древнем Египте возле храма Амона, которому и обязан своим названием. Возле священного места, был впервые обнаружен состав из верблюжьих экскрементов.
Получение аммиака и его производных
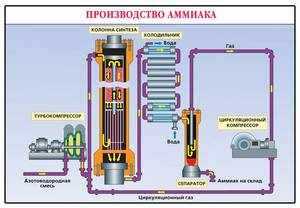 В промышленности вещество добывают во время реакции взаимодействия между водородом (H) и азотом (N2). Процесс получения (синтеза) разработал немецкий физик по фамилии Габер. Эта реакция стимулирует выделение тепла и снижение количества объёма.
В промышленности вещество добывают во время реакции взаимодействия между водородом (H) и азотом (N2). Процесс получения (синтеза) разработал немецкий физик по фамилии Габер. Эта реакция стимулирует выделение тепла и снижение количества объёма.
Чтобы достичь лучших результатов, необходимо извлекать аммиак при достаточно низких температурах и предельном давлении. Для получения этого газа в лабораториях применяют воздействие тяжёлых щелочей на соли аммония. При сгорании учитывается его высокая термическая сопротивляемость, поэтому при реакции поддерживают достаточное количество кислорода.
- Равновесное состояние достигается при помощи катализатора Fe с примесями оксидами алюминия и калия. Выход газа при температуре 500 °C и давлении 350 атм. Составляет 30%.
- Собирание вещества производится методом вытеснения воздуха из колбы, укреплённой дном кверху.
- Каталитическое окисление аммиака приводит к образованию оксида азота (NO) и воды (H2O). Такая реакция призвана сократить потери энергии при получении вещества.
- NH3 степень окисления атомов азота равняется 3. Эта вспомогательная величина облегчает учёт переноса электронов.
- Чтобы получить азоимид (H3N), бесцветную и взрывоопасную кислоту, используют воздействие NaN3 на NaNH2. Вещество чрезвычайно токсично и сходно с цианидами.
- В промышленности используют азотистую кислоту, имеющую формулу HNO3. Она применяется в производстве удобрений, красителей, лекарств, а также в военном деле.
- При горении, реакции с кислородом (O2), аммиак образует азот и обыкновенную воду, температура его кипения составляет — 33,4 °С.
- При взаимодействии оксида меди (CuO) и аммиака начинается выделение металла, азота и воды.
- Диссоциация аммиачного раствора происходит при нагревании до 600 — 650 °C. В процессе обязательно участвует специфический катализатор. Чтобы рассчитать константу диссоциации, используют химическое уравнение.
Вещество повседневно используется в химической промышленности и медицине
Оно относится к 4-му классу опасности, поэтому требует соблюдения максимальных мер предосторожности при работе с ним
Характеристика аммиака
Аммиак при атмосферном давлении и температуре выше -33,4 °С находится в газообразном состоянии. Он не имеет цвета, но обладает резким характерным запахом нашатырного спирта. Плотность газообразного аммиака составляет 0,823 кг/м3 (легкий газ).
Газообразный аммиак — горючий газ с удельной теплотой сгорания 18 688 кДж/кг. Температура самовоспламенения I аммиака в стальной бомбе, обладающей каталитическим действием, равна 650 °С. Область воспламенения аммиачно-воздушной смеси находится в пределах 15-33,6 %. Минимальное взрывоопасное содержание кислорода 16,2 % об. Наиболее легко воспламеняемая аммиачно-воздушная смесь стехиометрической концентрации требует энергию зажигания 680 мДж. Давление взрыва такой смеси — 580 кПа. Нормальная скорость распространения пламени не превышает 0,1 м/с при атмосферном давлении и температуре окружающего воздуха, что в десятки раз медленнее, чем у водорода. Вне зоны воспламенения аммиачно-воздушная смесь не горит
Сжиженный аммиак — трудногорючее вещество, которое горит только при наличии над его поверхностью постоянного источника воспламенения достаточной мощности. При проливе сжиженный аммиак, приобретая при атмосферном давлении температуру -33,4 °С, вскипает с мгновенным образованием аэрозольного облака, которое не загорается от источника огня.
Аммиак хорошо растворяется в воде с выделением тепла, интенсифицирует испарение при разбавлении водой. Для снижения загрязнения воздушного пространства разбавлять и смывать жидкий аммиак следует не менее чем десятикратным количеством воды. Удельное объемное электрическое сопротивление жидкого аммиака — 0,8 • 105 Ом • м, поэтому накопление опасных потенциалов статистического электричества при транспортировании не наблюдается.
Газообразный аммиак токсичен, по степени воздействия на организм человека относится к 4-му классу опасности. Предельно допустимая концентрация аммиака в воздухе рабочей зоны ПДК з = 20 мг/м3, максимально разовая концентрация для населенных пунктов — 0,2 мг/м3. Порог восприятия обоняния не превышает 55 мг/м3. Концентрация аммиака С= 1500 мг/м3 (0,21 %) вызывает смертельный исход.
Свойства нашатырного спирта
Во время процесса дыхания пары гидроксида аммиака попадают внутрь организма, при этом вещество активно начинает взаимодействовать с тройничным нервом, при этом рефлекторно возбуждая дыхательный центр. Концентрированный раствор способен вызывать колликвацию (растворение, размягчение) белков микробных клеток. Средство еще часто применяется как скорая помощь для возбуждения дыхания и выведения человека из обморочного состояния. Кроме того, аммиачный раствор:
- при наружном применении улучшает регенерацию тканей, расширяет сосуды, стимулирует отток метаболитов;
- обладает антисептическим действием;
- оказывает раздражающее воздействие на экстерорецепторы кожи;
- блокируют поток болевых импульсов из патологических очагов;
- провоцирует местное высвобождение кининов, простагландинов;
- влияет на деятельность сердца и тонус сосудистых стенок;
- снижает гипералгезию, напряжение мышц, спазмы, оказывая отвлекающее действие;
- при вдыхании препарата происходит увеличение кровяного давления;
- подавляет очаги возбуждения;
- способствует быстрому выходу мокроты;
- воздействуя на рвотный центр, повышает возбудимость;
- прием внутрь в малых дозах стимулирует секрецию желез.

Применение
Раствор аммиака часто используется как лекарство и для бытовых нужд. В медицине средство применяют для выведения из обморока, возбуждения дыхания. При укусах насекомых делают примочки со средством, при невралгиях растирают больное место. Наружно используется спирт для обеззараживания рук врачей перед операцией. Инструкция по применению препарата указывает, что доза вещества должна подбираться индивидуально, исходя из показаний.
Применение в быту
Аммиачная вода полезна при выведении пятен с мягкой мебели, одежды. Чтобы очистить любимую вещь, текстильную обувь или обивку, необходимо пару чайных ложек средства соединить со стаканом воды и залить получившимся раствором пятно на несколько минут. Затем прополоскать прохладной водой. Запах быстро выветрится, пятна моментально исчезнут.
При выведении тараканов тоже хорошо помогает моногидрат аммиака. Для этого следует немного средства добавить в ведро с водой при мытье пола, мебели и стен (на литр воды примерно 1 ч. л.). Резкий запах прогонит незваных гостей, особенно если процедуру делать раз в неделю. Чтобы отдых на природе не был испорчен укусами комаров и мошки, необходимо взять с собой раствор аммиака и разбрызгать его вокруг. После данной обработки насекомые уже не побеспокоят.
Для очистки серебряных, золотых изделий, предметов сантехники тоже подходит раствор аммиака. Чтобы избавиться от неприятного черного налета, необходимо взять воду, зубной порошок, моногидрат аммиака в соотношении 5:2:1. Далее изделие следует протереть мягкой тканью или марлей, смоченной в растворе. После этого ополоснуть водой, вытереть насухо. Украшения с драгоценными камнями и жемчугом не стоит чистить таким способом.
Для комнатных цветов
Применение раствора аммиака для растений основано на большом содержании в нем азота и отсутствии балластных веществ. Препарат в разбавленном виде – это идеальная подкормка для домашних цветов. Чтобы приготовить самое простое удобрение с NH4OH, необходимо растворить одну столовую ложку вещества в трех литрах воды. Полученным раствором необходимо поливать растения под корень. Если домашние цветы поразила тля, необходимо их вынести на балкон и опрыскать раствором из пятнадцати миллилитров спирта, трех литров воды и двух капель шампуня.
В огороде
Раствор аммиака является незаменимым помощником на дачном участке. Часто препарат используют для восполнения недостатка азота и в качестве профилактики болезней деревьев, растений, кустарников, ягод. Для подкормки понадобиться 4 л воды и 50 мл раствора. Проводить полив растений таким составом следует с момента посадки и до конца июня. Средство еще отлично отпугивает комаров, тлю, мошку. В хозяйстве применяется лишь технический раствор спирта 25%.
Аммиак для растений – это отличная подкормка. Хорошим урожаем отзовутся на раствор кустарники: слива, вишня, ежевика, малина. Вещество необходимо использовать для увеличения роста, в период цветения. Больше всего азота потребляет капуста, кабачки, лук, тыква, перец, картофель, баклажаны. Существуют культуры, которым в умеренном количестве нужен азот: огурцы, томаты, свекла, чеснок, кукуруза, кусты крыжовника и смородины.

Применение в медицине
Аммиачный раствор часто используют для приведения человека в чувства и при обмороке. Кроме того, применение нашатырного спирта в медицине возможно при:
- отравлениях (пищевых, алкогольных, токсических);
- невралгии;
- укусах насекомых;
- головной, зубной боли;
- похмелье;
- миозите;
- суставной боли;
- отите;
- грибке ногтей.
В косметологии моногидрат аммиака тоже нашел широкое применение. Если использовать вещество вместе с глицерином, то это будет отличное средство для сухой кожи ног, локтей, рук. Лосьон на основе данных ингредиентов помогает быстро вернуть мягкость, избавиться от трещин. Средство отлично подходит и для лечения волос, его можно применять в качестве ополаскивателя после использования шампуня. Для этого надо чайную ложку спирта растворить в стакане теплой воды.
Таблица
И в завершение подведем итог, в чем разница между аммиаком и нашатырным спиртом.
Нашатырный спирт – это прозрачная летучая жидкость с химическим ядовитым запахом. Состоит из аммиака, газа, который растворяется в воде, так как вода и аммиак являются полярными молекулами.
Аммиак – это азотоводородистое соединение. В хим. промышленности его используют для самых разных целей.
Природный аммиак выходит при разложении азотосодержащих органических останков.
Азот с водородом образуют бесцветный газ с резким удушающим запахом и очень горьким вкусом.
Аммиак относится к очень ядовитым продуктам. Он сильно раздражает слизистые оболочки. Острое отравление аммиаком вызывает поражение слизистых оболочек глаз и легких, одышку, воспаление кожных покровов.
Если здоровый человек вдохнет пары аммиака, его печень превратит аммиак в мочевину, которая выйдет из организма с водой.
Однако люди с нарушенной функцией печени не смогут быстро избавиться от этого вещества. Результатом будет чрезмерная концентрация аммиака в крови. Это может вызвать приступы и кому, исход бывает фатальным.
Аммиак следует хранить в стальных баллонах, их окрашивают в желтый цвет, с черной надписью – аммиак. Сам аммиак применяют ограниченно и обычно в виде водных растворов (аммиачная вода – как жидкое удобрение, нашатырный спирт – в медицине).
Нашатырный спирт смешивается с водой и спиртом во всех пропорциях. Он обычно содержит 10% аммиака и 90% воды.
В таком виде его используют для решения бытовых проблем. Для промышленности данный спирт изготавливают в два этапа: сначала вырабатывают гидрат аммония из аммиака. Полученный гидрат смешивают с водой. В итоге получается нашатырный спирт (ещё его называют гидроксид аммония).
Для любителей «горячительного» эта жидкость точно не подойдет, так как спирта в ней нет. Дело в том, что в средние века спиртом называли все летучие вещества (от лат. spiritus — дух). Если говорить по существу – это просто очень необычная щелочь.
Применение нашатырного спирта
Человек знал об этом веществе с древних времен, о нем писал римский автор Плиний. В средние века начали получать жидкую форму из ферментированной мочи, её использовали для окраски одежды.
Гидроксид аммония — это универсальный продукт, который помогает решать многие задачи в доме. Вместо того, чтобы переполнять свои полки специализированными очистителями, можно использовать одну бутылку этого средства для решения многих бытовых проблем.
- Он используется для очистки полов, стен, душевых кабин, прилавков, плиток и бытовой техники. Протертые им вещи и приборы начинают блестеть с невероятной силой. Мучнистую росу, царапины, потускневшие приборы и пятна на одежде, а также ковровые пятна можно удалить этим спиртом.
- Это едкое вещество отлично поможет избавить жилище от комаров и муравьев. Они терпеть не могут запах нашатыря. Также можно расставить в квартире емкости с этим средством, чтобы избавиться от неприятного запаха сигарет, краски и др.
- В медицинских целях его применяют, например, при обмороках. Так как он обладает очень резким запахом, при поднесении ватки с этим веществом к носу человека раздражаются рецепторы, человек приходит в сознание.
- Кроме того разбавленный аммиак прекрасно подходит для обеззараживания рук. Им часто пользуются хирурги перед операцией.
Меры безопасности
В связи с тем, что водный раствор аммиака принадлежит к 4 классу опасности (очень высокая опасность), взаимодействовать с ним необходимо крайне осторожно. Необходимо соблюдать все меры безопасности: нужно использовать медицинские перчатки, респиратором желательно защитить лицо, хранить это средство необходимо вдали от детей, емкость должна быть плотно закрытой
Нельзя позволять этому средству соприкасаться с глазами или иметь длительный контакт с кожей. Необходимо избегать вдыхания паров аммиака и всегда надо использовать данный продукт в хорошо проветриваемом помещении.
Он может повредить резину и некоторые пластмассы. Никогда нельзя смешивать нашатырный спирт и отбеливатель — это высвобождает токсичный газообразный хлор. По этой причине надо быть осторожным, чтобы не допустить смешивания данного продукта с очистителями для туалета и плитки на основе отбеливателя.
Многие медицинские средства могут использоваться как для лечебных, так и для хозяйственных целей, например, раствор нашатырного спирта часто применяют, чтобы уничтожить вредителей или для очистки мебельной обивки из кожи. Кроме того, таким веществом можно обрабатывать садовые растения, использовать для подкормки огурцов, а также при чистке серебра, золота, предметов сантехники.
Применение аммиака для растений: польза и вред
Аммиак – бесцветный газ с неприятным запахом мочи. Соединение его с водой представляет собой нашатырный спирт или нашатырь. Садоводы пользуются этими тремя понятиями как равнозначными.
Аммиак отличается высоким содержанием азота (82%), который является основным «продуктом питания» для любого растения. В воздухе он тоже содержится в большом количестве (72%), но растения способны его усваивать только из почвы.
Недостаток азота в почве нарушает выработку у растений хлорофилла.
Признаки недостатка азота или заболевания хлороз:
- желтые или бледные листья;
- хрупкие стебли;
- слабое цветение;
- отсутствие завязи.
В таких случаях необходимы подкормки азотными удобрениями. В их качестве можно использовать аммиак. Он дает видимый эффект уже после нескольких применений. Положительно влияет на состояние растения и гарантирует урожайность.
Его раствор имеет преимущество перед твердыми азотосодержащими удобрениями:
- аммиачная селитра;
- карбамид.
Избыток последних в почве приводит к накоплению нитратов (солей азотной кислоты) в корнях, листьях, а главное – плодах. Этим грешат тепличные и выращенные в промышленных масштабах, овощи и фрукты. Плоды с высоким содержанием нитратов способны вызвать тяжелое отравление организма.
«Перекормить» растения раствором аммиака практически невозможно. Хотя при злоупотреблении удобрениями, это возможно.
Несоблюдение дозировки и кратности подкормок может привести к наращиванию зеленой массы в ущерб цветению и плодообразованию. Кроме того, избыток азота увеличивает риск грибковых заболеваний.
Способы получения, уравнение реакции, сфера применения
Существуют разные способы синтеза аммиака. В лабораторных условиях соединение получают путем химической реакции солей аммония со щелочами. Так как аммиак обладает высокой степенью растворимости в воде, чтобы получить чистый аммиак, необходимо использовать твердые вещества.
В процессе синтеза в ступке интенсивно растирают смесь соли аммония и основания, а затем, нагревают смесь. Газ, который выделился в ходе реакции, собирают в пробирку. Так как аммиак легче воздуха, пробирку необходимо перевернуть вверх дном. Определяют присутствие аммиака с помощью влажной лакмусовой бумажки, которая приобретает синюю окраску при контакте с этим веществом.
Другой лабораторный способ получения аммиака заключается в гидролизе нитридов.
В промышленных масштабах аммиак синтезируют с помощью процесса Габера, то есть прямого получения вещества из водорода и азота.
Реакция протекает в условиях температуры 500-550°C и при наличии катализатора. Получение аммиака происходит под давлением 15-30 МПа. Роль катализатора играет губчатое железо с добавками в виде оксидов алюминия, калия, кальция, кремния. Полное использования исходных веществ возможно с помощью методики рециркуляции непровзаимодействовавших реагентов, то есть азот и водород, которые не вступили в химическую реакцию, вновь возвращают в реактор.
Аммиак является токсичным веществом. Несмотря на эту особенность, которую удалось обнаружить ученым, соединение нашло широкое применение в разных сферах хозяйственной деятельности. Большая доля производимого аммиака идет на изготовление разнообразной продукции химической промышленности:
- Аммиачные и аммиачно-нитратные удобрения, в том числе, аммиачная селитра, сульфат аммония, хлористый аммоний. Перечисленные удобрения используют для подкормки сельскохозяйственных культур. В процессе внесения в почву удобрений их количество нормируется, так как содержащиеся в них вещества могут выпадать в осадок и накапливаться в спелых овощах и фруктах.
- Сода. Кальцинированную соду получают с помощью аммиачного метода. Аммиак используют, чтобы насыщать солевой рассол. Рассматриваемый способ распространен в промышленном выпуске соды.
- Азотная кислота. Промышленный процесс производства азотной кислоты основан на каталитическом окислении аммиака.
- Взрывчатые вещества. Нитрат аммония нейтрален к механическому воздействию. С другой стороны, в определенных условиях данное соединение приобретает высокие взрывчатые свойства. Данный факт объясняет его применение в изготовлении зарядов со взрывчатыми веществами. В результате получают аммониты, которые являются аммиачными взрывчатыми веществами.
- Растворитель. Аммиак, пребывая в жидком агрегатном состоянии, подходит для применения в качестве растворителя различных органический и неорганических веществ.
- Аммиачная холодильная установка. Аммиак используют в холодильном оборудовании как хладагент. Вещество не вызывает парниковый эффект и характеризуется более низкой стоимостью по сравнению с фреонами. Данные факторы объясняют популярность аммиака в качестве холодильного агента в промышленных установках.
- Нашатырный спирт (водный раствор аммиака). Данное вещество нашло широкое применение в медицине и в быту. С помощью нашатырного спирта эффективно устраняют пятна с одежды различного происхождения, а также нейтрализуют кислоты.
Аммиак активно применяют в медицинской сфере в определенной концентрации (10% раствор аммиака), который называют нашатырным спиртом. Если человек падает в обморок, с помощью данного вещества его можно привести в чувство. Нашатырный спирт является рвотным средством. С этой целью его разводят водой и в малых количествах принимают внутрь. Данная методика востребована в случае алкогольных отравлений. Из нашатырного спирта делают примочки и обрабатывают ими укусы насекомых. В хирургии разведенным в воде нашатырным спиртом обрабатывают руки.
Правила применения
Раствор аммиака – это токсическое вещество, поэтому при его неправильном использовании может возникнуть рефлекторная остановка дыхания, ожог желудка (при приеме неразведенного препарата). Как правило, средство применяют ингаляционно, местно и внутрь. В хирургической практике им моют руки. При продолжительном воздействии препарата на организм, могут появиться некробиотические и воспалительные изменения в тканях.
Перед использованием вещества, следует тщательно ознакомиться с инструкцией или проконсультироваться со специалистом. При случайном повреждении емкости с препаратом следует быстро открыть окно и проветрить помещение. При попадании на слизистые оболочки и в глаза нужно промыть пораженные участки большим количеством проточной воды и обратиться за помощью к врачу.
Аммиак от прыщей
Раствор аммиака – отличное средство при жирной коже лица, которая склонна к возникновению прыщей и черных точек. Он может использоваться для умывания. При этом необходимо половину чайной ложки вещества развести стаканом теплой воды. Кроме того, проблемные участки можно протирать раствором гидроксида аммиака с концентрацией 1-2 % с помощью ватного тампона.
Меры предосторожности
Нельзя забывать, что аммиак – сильный яд. Вдыхание его паров в больших количествах может вызвать остановку дыхания и нарушение сердечного ритма. Такие отравления впоследствии потребуют продолжительного лечения.
Если концентрированный раствор нашатырного спирта попадет на кожу, он приведет к образованию химического ожога. В обоих случаях не стоит заниматься самолечением, а следует обратиться в медицинское учреждение.
Чтобы избежать подобных последствий, при работе с аммиаком нужно соблюдать меры предосторожности:
- использовать респиратор и перчатки;
- разводить на открытом воздухе или в проветриваемых помещениях;
- не смешивать с любыми другими активными веществами, кроме йода;
- не проводить обработку в жаркую, солнечную погоду;
- не работать с препаратом людям, страдающим вегетососудистой дистонией.
Немного из истории
Аммиак впервые был получен английским химиком Джозефом Пристли (кстати, одновременно и священником – странное сочетание, не правда ли?) в 1774 году. Он назвал открытый им газ «щелочным воздухом», химического состава которого определить не смог. Это сделал 11 лет спустя, в 1785 году, французский химик Клод Луи Бертолле, известный еще и как изобретатель «бертолетовой соли» – состава, нашедшего широкое применение в пиротехнике и медицине. Почему газ получил именно это название?
На этот счет существует две версии, одна из которых связана с именем древнеегипетского бога Амона, а вторая – со сходным по звучанию оазисом Аммона в Северной Африке. Согласно первой, поклоняющиеся Амону люди во время обряда нюхали нашатырь (химическая формула NH 4 Cl), при нагревании выделяющий аммиак. По второй версии, в оазисе Аммона, находящемся на перекрестке оживленных караванных путей, в результате постоянного нахождения там большого числа вьючных животных скапливалось огромное количество продуктов их жизнедеятельности. А мочевина, быстро разлагаясь в жарком климате, выделяет аммиак. Какая из двух версий верна – неизвестно.
Отличие аммиака от нашатырного спирта прежде всего в том, что в обычных условиях они находятся в разных агрегатных состояниях. Аммиак – газ, сжижающийся при температуре около –33 по Цельсию. А нашатырный спирт – жидкость, имеющая тот же неприятный запах, что и аммиак. Интересный факт: для транспортировки аммиака из Тольятти в Одессу проложен единственный в своем роде аммиакопровод длиной около 2,1 тысячи километров.
Различия между аммиаком и нашатырным спиртом
Многие думают, что аммиак – это просто второе название нашатырного спирта. Но на деле это два разных вещества. Основным их отличием является различное агрегатное состояние этих соединений в одинаковых условиях:
- Нашатырь является жидкостью.
- Аммиак – это газ, который может перейти в состояние жидкости только при -33 градусах Цельсия.
Аммиак можно преобразовать в препарат путем длительной реакции:
- Аммиак преобразуют в гидроксид аммония.
- После этого его растворяют в воде, в результате чего образуется нашатырь.
При использовании в быту аммиак просто растворяют в воде, пропуская первый этап реакции.