Ацетон в быту
В быту ацетон также может стать верным помощником:
1) Им можно обезжирить самые разные поверхности перед их последующей покраской или другой обработкой. Так, например, перед нанесением лака металлическую поверхность тщательно протирают лоскутом натуральной, желательно неокрашенной ткани или обрабатывают кистью с натуральным ворсом, смоченной в ацетоне.
Важно: в случае, если поверхность полированная, ткань или кисть необходимо предварительно прополоскать в ацетоне до тех пор, пока жидкость не станет абсолютно прозрачной. Качественно обезжиренная поверхность металла не имеет белых разводов
Таким же способом можно обработать очищенный полированный камень или стекло;
2) Ацетон поможет бесследно удалить некоторые виды пятен.
Остатки силикона: смочите обычный ватный диск небольшим количеством жидкости и аккуратными движениями удалите налет. Если вам необходимо устранить капли или целые полосы застывшего силикона, сначала уберите основной объем с помощью ножа или шпателя.
Суперклей с тканевой поверхности: дайте клею высохнуть, затем намочите ватный тампон и приложите его к пятну на пару минут, соскребите клей не очень острым кухонным ножом; при необходимости повторите процедуру несколько раз.
Пятна от краски на одежде: также на ватный тампон или диск наносят ацетон и обрабатывают пятно по направлению от краев к середине. Главное помнить, что данный растворитель не стоит использовать для кожи или синтетических тканей, а при очищении окрашенных тканей сначала обязательно проверяйте воздействие ацетона на незаметном участке.
Работая с ацетоном, не забывайте соблюдать элементарные правила безопасности: хорошо проветриваемое помещение, отсутствие источников возгорания, хранение в плотно закрытой таре в темном и сухом месте, не доступном для детей.
Сложно найти человека, которому ни разу в жизни не приходилось иметь дело с ацетоном — покупать его, использовать для тех или иных нужд, хранить, изучать и так далее. На текущий момент продающийся по достаточно доступным ценам ацетон является одним из самых востребованных и важных химических веществ — важных для самых разнообразных отраслей промышленности.
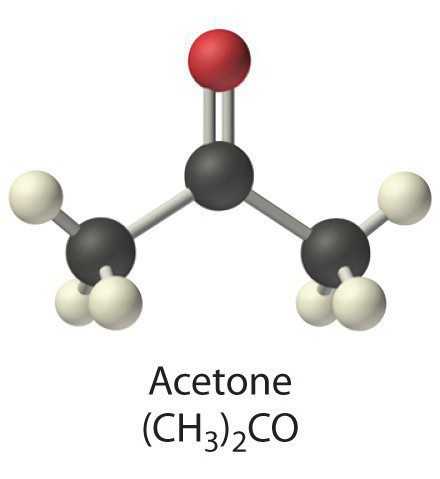
Каковы же физические свойства технического ацетона? Он представляет собой абсолютно бесцветную и абсолютно прозрачную жидкость с легко узнаваемым запахом. Эта жидкость крайне восприимчива к огню и очень легко растворяет целый ряд органических веществ и солей. Также вы можете купить ацетон и смешивать его в разных пропорциях с водой, эфирами и спиртами.
Применение
Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, кетен, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, бисфенол А и так далее; пример:
Последний широко применяется при синтезе поликарбонатов, полиуретанов и эпоксидных смол.
Ацетон также является популярным растворителем. В частности он используется как растворитель
- в производстве лаков;
- в производстве взрывчатых веществ;
- в производстве лекарственных препаратов;
- в составе клея для киноплёнок как растворитель ацетата целлюлозы и целлулоида;
- компонент для очистки поверхностей в различных производственных процессах;
- как очиститель инструмента и поверхностей от монтажной пены — в аэрозольных баллонах.
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который под давлением в чистом виде крайне взрывоопасен. Для этого используют ёмкости с пористым материалом, пропитанным ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена.
Ацетон используется также при экстракции многих растительных веществ.
Лабораторное применение
В органической химии ацетон применяется в качестве полярного апротонного растворителя, в частности, в реакции алкилирования
для окисления спиртов в присутствии алкоголятов алюминия по Оппенауэру
Ацетон применяется для приготовления охлаждающих бань в смеси с «сухим льдом» и жидким аммиаком (охлаждает до температуры −78 °C).
В лабораториях используется для мытья химической посуды благодаря низкой цене, малой токсичности, высокой летучести и лёгкой растворимости в воде, а также для быстрой сушки посуды и неорганических веществ.
Очистка
Технический ацетон обычно содержит воду, иногда — спирт и другие восстановители. Проба на присутствие восстановителей:
Сушат ацетон безводным поташом (около 5 % от веса ацетона), нагревая смесь в течение нескольких часов с обратным холодильником, переливают в другую колбу и перегоняют над свежим осушителем. Металлический натрий и щёлочи непригодны для сушки ацетона.
Для использования в качестве растворителя при окислении органических веществ перманганатом калия ацетон перегоняют в присутствии небольшого количества перманганата калия (до устойчивой фиолетовой окраски раствора), при этом для удаления воды добавляют безводный поташ.
Очень чистый ацетон получают разложением аддукта ацетона и бисульфита натрия либо продукта присоединения ацетона и иодистого натрия:
Обнаружение
В химико-токсикологическом анализе для обнаружения ацетона применяют реакции с растворами йода, нитропруссида натрия, фурфурола, ο-нитробензальдегида и метод микродиффузии.
Реакция на образование йодоформа.
При взаимодействии ацетона с раствором йода в щелочной среде образуется трииодметан (йодоформ):
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора аммиака и несколько капель раствора йода в йодиде калия (йодной настойки). В присутствии йода образуется желтый осадок трииодметана с характерным запахом, а его кристаллы имеют характерную гексалучевую форму. Предел обнаружения — 0,1 мг ацетона в пробе.
Реакция с нитропруссидом натрия (проба Легаля).
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую. Кетоны, в молекулах которых отсутствуют метильные группы, непосредственно связанные с кетоновыми (СО—) группами, не дают такой реакции. Соответственно такие кетоны как метилэтилкетон, метилпропилкетон и другие — также дадут красную окраску с нитропруссидом.
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора гидроксида натрия и 5 капель 1%-го свежеприготовленного раствора нитропруссида натрия. При наличии ацетона в пробе появляется красная или оранжево-красная окраска. При прибавлении 10%-го раствора уксусной кислоты до кислой реакции через несколько минут окраска переходит в красно-фиолетовую или вишнёво-красную. Следует заметить, что бутанон дает аналогичную окраску с нитропруссидом натрия.
Симптомы отравления
При проникновении растворителя внутрь происходит ожог слизистых оболочек рта и органов ЖКТ, который сопровождается выраженным отеком. Если принять 50 мл ацетона, летального исхода не избежать — это смертельная доза для организма человека.
При употреблении вещества внутрь происходит некроз тканей, страдают сердце и сосуды. Отравление сопровождается сильным головокружением, потерей сознания, угнетением дыхания, рвотой и тошнотой. У человека краснеет язык. Резко снижается артериальное давление, что провоцирует коллапс. Изо рта человека можно почувствовать выраженный запах растворителя. Присутствуют жалобы на сильные боли в животе. Появляются нарушения сознания, признаки сонливости и спутанность речи.
Отравление через органы дыхания проявляется другими симптомами. Признаки менее выражены. При вдыхании паров ацетона возникают слезотечение, воспаление бронхов и легких, в результате чего может начаться кашель, появляется одышка. В тяжелых случаях присоединяются сильные головные боли, ломота в суставах, отек слизистой оболочки рта и потеря сознания.
Если вещество попало в глаз, возникает слезотечение. Слизистая оболочка краснеет, может лопнуть сосуд, присоединяются боли.
При попадании большого количества растворителя может произойти ухудшение зрения, которое будет трудно устранить самостоятельно.
Способы получения
В настоящее время основное количество кислородсодержащего соединения получают из пропена. Технический ацетон (ГОСТ 2768-84) должен обладать определенными физическими и эксплуатационными характеристиками.
Кумольный способ состоит из трех стадий и предполагает производство ацетона из бензола. Сначала путем его алкилирования с пропеном получают кумол, затем окисляют полученный продукт до гидропероксида и расщепляют его под воздействием серной кислоты до ацетона и фенола.
Кроме того, это карбонильное соединение получают при каталитическом окислении изопропанола при температуре около 600 градусов по Цельсия. В качестве ускорителей процесса выступают металлическое серебро, медь, платина, никель.
Среди классических технологий производства ацетона особый интерес представляет реакция прямого окисления пропена. Данный процесс осуществляется при повышенном давлении и присутствии в качестве катализатора хлорида двухвалентного палладия.
Также можно получить ацетон путем брожения крахмала под воздействием бактерий Clostridium acetobutylicum. Кроме кетона среди продуктов реакции будет присутствовать бутанол. Среди недостатков этого варианта получения ацетона отметим несущественный процентный выход.
Токсичность ацетона и распространенность отравлений
Ацетон сравнительно мало токсичен. Нелсон и др. нашли, что максимально допустимая концентрация ацетона в воздухе при 8-часовом воздействии составляет 0,02%. Дринкер и Кук считают, что максимально допустимая концентрация ацетона равна 0,05–0,25%. Смит и Майерс приводят случаи острого отравления парами смеси ацетона и бутанона при концентрациях порядка 0,1%. Неопубликованные исследования Штернера, Оглезби и Фассета показали, что из всех растворителей, применяемых в промышленности, ацетон является одним из наименее токсичных и в этом отношении вполне сравним с этиловым спиртом. В настоящее время максимально допустимой концентрацией принято считать 0,1%. Пребывание в течение короткого времени в атмосфере, в которой концентрация ацетона намного превышает указанную, не причиняет вреда. Пределы воспламенения в воздухе 2,55–12,8 об.%. Ацетон является естественным метаболитом организма человека и животных. Он входит в триаду соединений (бета-оксибутират, ацетоацетат и ацетон), обозначаемых, как кетоновые тела. Ацетон образуется путем неферментативного декарбоксилирования ацетоуксусной кислоты. В нормальных условиях содержание ацетона в сыворотке крови человека обычно не превышает 6 мг/л (0,1 ммоль/л). Трехдневное голодание приводит к увеличению концентрации ацетона в сыворотке у лиц с ожирением до 17 мг/л, а у здоровых людей, не страдающих ожирением до 44 мг/л В условиях дефицита глюкозы (голодание) или при снижении ее биодоступности (сахарный диабет), содержание кетоновых тел в крови может возрастать в десятки раз. При этом они действуют и как часть регуляторного механизма с обратной связью, блокируя чрезмерную мобилизацию жирных кислот из жировой ткани и ослабляя тем самым токсическое действие последних. Токсичность ацетона, поступающего в организм извне хорошо изучена. Острая токсичность ацетона (LD50), поступающего через желудок составляет по данным разных авторов для крыс – 5,8–9,8 г/кг, для мышей – 3,0–5,25 г./кг, для кроликов и собак – 3,8–8,0 г/кг. По этому показателю ацетон мало отличается от этанола. Эффективная однократная действующая доза (EDmin) ацетона для человека, определяемая по его влиянию на нервную систему, почки и кровь при условии поступления через желудок, составляет 2,9 г/кг. Доза, обладающая минимальным токсическим действием (ПДхр.), определяемая на крысах при условии внутрижелудочного введения ацетона на протяжении 6 мес. составляет 7 мг/кг. Его предельно допустимая концентрация (ПДК) в воде общего пользования составляет 2,2 мг/л. Токсическое действие ацетона связано с наркотическим влиянием на ЦНС, прижигающим действием на слизистую оболочку дыхательных путей и органов пищеварения, метаболическим ацидозом и негативным влиянием на развитие плода.
Другие полезные свойства ацетона
Помимо этого, наши клиенты покупают ацетон для обезжиривания поверхностей, для синтеза и производства разного рода органических веществ, например:
- Ацитоцианидрин
- Уксусный ангидрид
- Растворители многих видов
Но и это ещё не всё. Посредством ацетона можно обеззараживать практически любые поверхности (в том числе натуральные мех и шерсть). Без труда купив ацетон в магазине (в том числе и у нас), вы сможете применять его для изготовления небьющегося стекла, киноплёнки, синтетического каучука или искусственного шёлка. Ацетон помогает в процедуре окрашивания тканей и печатном деле.
Особенности ацетона
Ацетон технический является самым распространенным растворителем, применяемым в современном строительстве. Так как данное соединение имеет невысокий уровень токсичности, его также применяют в фармацевтической и пищевой промышленности.
Ацетон технический используется в качестве химического сырья при производстве многочисленных органических соединений.
Медики считают его наркотическим веществом. При вдыхании концентрированных паров ацетона возможно серьезное отравление и поражение центральной нервной системы. Данное соединение представляет серьезную угрозу для подрастающего поколения. Токсикоманы, которые используют пары ацетона для того, чтобы вызвать состоянием эйфории, сильно рискуют. Медики опасаются не только за физическое здоровье детей, но и за их психическое состояние.
Смертельной считается доза от 60 мл. При попадании в организм значительного количества кетона наступает потеря сознания, а через 8-12 часов — смерть.

Связанные ответы
Все ли пластмассы растворяет ацетон?
Существуют все виды пластмасс. Если конкретный пластик имеет достаточно близкое сходство с ацетоном, ацетон растворит его или, по крайней мере, воздействует на его поверхность, размягчая, размазывая или даже растворяя пластик. Другие пластмассы, несхожие с ацетоном, останутся незатронутыми растворителем.
Какие пластмассы не растворяются в ацетоне?
Многие виды пластмасс не растворяются в ацетоне. Полипропилен и нейлон не подвержены его воздействию, неудивительно, что тефлон тоже прекрасно с ним справляется. Два вида пластика, которые растворяются в ацетоне, — это ПВХ и полистирол.
Какие материалы растворяет ацетон?
Ацетон — это прозрачная, бесцветная жидкость. Это растворитель, который может растворять или разрушать другие материалы, такие как краска, лак или жир.
Растворяет ли ацетон ПВХ?
Ацетон входит в список растворителей и при высокой концентрации растворяет ПВХ. Со временем можно ожидать повреждения труб из ПВХ. Кроме того, ацетон используется в качестве растворителя в большинстве коммерческих клеев для фитингов из ПВХ, поэтому ацетон ослабит фитинги, что приведет к утечкам.
Растворяет ли ацетон акриловый пластик?
При очистке акриловых листов никогда не используйте аммиак, ацетон, четыреххлористый углерод или бензин в качестве чистящего раствора. Эти виды растворителей могут вызвать трещины в акриловой пленке и придать поверхности матовый вид.
Повредит ли ацетон пластик ABS?
Ацетон, который большинство людей знают по его использованию в покраске, является растворителем, который может растворять некоторые пластмассы, включая ABS.
Расплавит ли ацетон пакет Ziplock?
Ацетон повредит поверхность пластика, размягчит его, размажет или даже растворит.
Каких материалов следует избегать при работе с ацетоном?
Условия, которых следует избегать: Открытое пламя, искры, статический разряд, тепло и другие источники воспламенения. Длительное воздействие солнечного света. Несовместимые материалы: Бурно реагирует с: окислителями (например, пероксидами), органическими кислотами (например, уксусной кислотой), сильными восстановителями (например, гидридами).
Можно ли использовать пластиковую миску для ацетона?
Ацетон повреждает дерево, пластик и т.д. Если вы хотите использовать миску — используйте старую стеклянную миску.
Что не может растворить ацетон?
Ацетон не способен растворить ПЭНД. Пенополистирол интерпретируется в ацетоне. Ацетон может очень легко разбить пенополистирол, потому что пенополистирол исчезает в ацетоне за считанные секунды.
Безопасен ли пластик ПЭНД для ацетона?
Ацетон всегда следует хранить в бутылках из ПЭНД вдали от прямых солнечных лучей с надежной крышкой. Когда ацетон хранится в бутылках из ПЭТ, они обесцвечиваются через неделю, затем начинают расширяться и в конечном итоге протекают и лопаются.
Растворим ли полипропилен в ацетоне?
При повышенной температуре полипропилен может быть растворен в неполярных растворителях, таких как ксилол, тетралин и декалин….Polypropylene Chemical Compatibility Chart.
| Химические вещества | Совместимость |
|---|---|
| Ацетон | A-Excellent |
| Бромистый ацетил | Н/А |
| Ацетилхлорид (сухой) | D — Сильный эффект |
| Ацетилен | A1-Отличный |
Растворяется ли нейлон в ацетоне?
Ацетон не является растворителем для нейлона.
Диэтиловый эфир
Диэтиловый эфир (C2H5)2O — бесцветная легкоподвижная летучая жидкость со своеобразным запахом; d20-4 = 0,7135; tкип = 35,6°С; n20-D = 1,3526. Чрезвычайно легко воспламеняется; пары образуют с воздухом взрывоопасные смеси. Пары тяжелее воздуха примерно в 2,6 раза и могут стелиться по поверхности рабочего стола. Поэтому необходимо следить за тем, чтобы поблизости (до 2-3 м) от места работы с эфиром все газовые горелки были потушены, а электроплитки с открытой спиралью отключены от сети.
При хранении диэтилового эфира под действием света и кислорода воздуха в нем образуются взрывчатые перекисные соединения и ацетальдегид. Перекисные соединения являются причиной чрезвычайно сильных взрывов, особенно при попытке перегнать эфир досуха. Поэтому при определении температуры кипения и нелетучего остатка эфир следует предварительно проверить на содержание перекисей. При наличии перекисей эти определения проводить нельзя.
Для обнаружения перекиси в диэтиловом эфире предложены многие реакции.
1. Реакция с йодидом калия KI. Несколько миллилитров эфира встряхивают с равным объемом 2% водного раствора KI, подкисленного 1-2 каплями HCl. Появление коричневого окрашивания указывает на присутствие перекисей.
2. Реакция с титанилсульфатом TiOSO4. Реактив готовят растворением 0,05 г TiOSO4 в 100 мл воды, подкисленной 5 мл разбавленной H2SO4 (1:5). При встряхивании 2-3 мл этого реактива с 5 мл испытуемого эфира, содержащего перекисные соединения, появляется желтая окраска.
3. Реакция с бихроматом натрия Na2Cr2O7. К 3 мл эфира прибавляют 2-3 мл 0,01% водного раствора Na2Cr2O7 и одну каплю разбавленной H2SO4 (1:5). Смесь сильно взбалтывают. Синяя окраска эфирного слоя указывает на присутствие перекисей.
4. Реакция с ферротиоцианатом Fe(SCN)2. Бесцветный раствор Fe(SCN)2 под действием капли жидкости, содержащей перекись, окрашивается в красный цвет вследствие образования ферритиоцианата (Fe2+ > Fe3+). Эта реакция позволяет обнаруживать перекиси в концентрации до 0,001% (масс.). Реактив готовят следующим образом: 9 г FeSO4-7H2O растворяют в 50 мл 18% НСl
К раствору в открытом сосуде добавляют гранулированный цинк и 5 г тиоцианата натрия NaSCN; после исчезновения красного окрашивания добавляют еще 12 г NaSCN, осторожно взбалтывают и раствор отделяют декантацией
Чтобы удалить перекиси, применяют сульфат железа (II). При взбалтывании 1 л эфира обычно берут 20 мл раствора, приготовленного из 30 г FeSO4-7H2O, 55 мл Н2O и 2 мл конц. H2SO4. После промывания эфир встряхивают с 0,5% раствором KMnO4 для окисления ацетальдегида в уксусную кислоту. Затем эфир промывают 5% раствором NaOH и водой, сушат 24 ч над CaCl2 (150-200 г CaCl2 на 1 л эфира). После этого отфильтровывают CaCl2 на большом складчатом бумажном фильтре и собирают эфир в склянку из темного стекла. Склянку плотно закрывают корковой пробкой со вставленной в нее изогнутой под острым углом хлоркальциевой трубкой, наполненной CaCl2 и тампонами из стеклянной ваты. Затем, открыв склянку, быстро вносят в эфир натриевую проволоку, из расчета 5 г на 1 л эфира.
Через 24 ч, когда перестанут выделяться пузырьки водорода, добавляют еще 3 г натриевой проволоки на 1 л эфира и спустя 12 ч эфир переливают в колбу для перегонки и перегоняют над натриевой проволокой. Приемник должен быть защищен хлоркальциевой трубкой с CaCl2. Дистиллят собирают в склянку из темного стекла, которую после внесения 1 г натриевой проволоки на 1 л эфира закрывают корковой пробкой с хлоркальциевой трубкой и хранят в холодном и темном месте.
Если поверхность проволоки сильно изменилась и при добавлении проволоки снова выделяются пузырьки водорода, то эфир следует профильтровать в другую склянку и добавить еще порцию натриевой проволоки.
Удобный и весьма эффективный способ очистки диэтилового эфира от перекисей и одновременно от влаги — пропускание эфира через колонку с активным Al2O3. Колонки высотой 60-80 см и диаметром 2-4 см, заполненной 82 г Al2O3, достаточно для очистки 700 мл эфира, содержащего значительное количество перекисных соединений. Отработанный Al2O3 легко регенерировать, если пропустить через колонку 50% подкисленный водный раствор FeSO4-7H2O, промыть водой, высушить и провести термическую активацию при 400-450 °С.
Абсолютный эфир — весьма гигроскопичная жидкость. О степени поглощения влаги эфиром при его хранении можно судить по посинению безводного белого порошка CuSO4 при внесении его в эфир (образуется окрашенный гидрат CuSO4-5H2O).
Токсикология, охрана труда
Ацетон токсичен. По данным ПДК ацетона составляет 200 мг/м3 (среднесменная за 8 часов) и 800 мг/м3 (максимально-разовая). По данным ряда исследований, например средний порог восприятия запаха был в ~3 раза выше чем максимально-разовая ПДК, и в ~12 раз выше среднесменной ПДК. При этом у части работников порог был значительно выше среднего значения (например, более 30 и 120 ПДК соответственно). В исследовании среднее значение порога восприятия запаха было ещё выше — 11 000 ppm (28 000 мг/м3), что превышает среднесменную ПДК в 140 раз.
Ацетон ядовит, но относится к малоопасным веществам (класс опасности IV, категория безопасности для здоровья по NFPA — 1). Сильно раздражает слизистые оболочки: длительное вдыхание больших концентраций паров приводит к возникновению воспаления слизистых оболочек, отёку лёгких и токсической пневмонии. Пары оказывают слабое наркотическое действие, сопровождаемое, чаще всего, дисфорией. При попадании внутрь вызывает состояние опьянения, сопровождаемое слабостью и головокружением, нередко — болями в животе; в существенных количествах возникает выраженная интоксикация, хотя, как правило, отравления ацетоном не смертельны. Возможно поражение печени (токсический гепатит), почек (уменьшение диуреза, появление крови и белка в моче) и коматозное состояние. При ингаляционном воздействии ацетон выводится гораздо медленнее (в течение нескольких часов), чем поступает, и поэтому может накапливаться в организме.
Характеристика растворителя
Что лучше ацетон или растворитель? Все зависит от сферы применения. И прежде, чем выбирать один из составов, нужно подробно ознакомиться с каждым из них.
Растворяющая жидкость бесцветная, работать с ней нужно осторожно, используя средства индивидуальной защиты для глаз и органов дыхания. Если вам нужно убрать загрязнения с окрашенной поверхности, наносите минимальное количество состава, иначе можно удалить грязь вместе с краской
Растворитель можно использовать для:
- Покраски материалов. Работать можно с разными видами красок: эпоксидной, на нитро основе и так далее.
- Разведение краски.
- Удаление жира с металлических поверхностей.
- Очистка строительных и ремонтных инструментов.
Сегодня приобрести состав с концентрацией вещества более, чем 60% практически невозможно. В нашей стране производство и продажу строго контролируют, так как он достаточно популярен среди токсикоманов.
Метиловый спирт (метанол)
Метиловый спирт (метанол) СН3ОН — бесцветная легкоподвижная горючая жидкость, с запахом, подобным запаху этилового спирта; d20-4 = 0,7928; tкип = 64,51 °С; n20-D = 1,3288. Смешивается во всех отношениях с водой, спиртами, ацетоном и другими органическими растворителями; не смешивается с алифатическими углеводородами. Образует азеотропные смеси с ацетоном (tкип = 55,7°С), бензолом (tкип = 57,5 °С), сероуглеродом (tкип = 37,65 °С), а также со многими другими соединениями. С водой метиловый спирт не образует азеотропных смесей, поэтому большую часть воды можно удалить перегонкой спирта.
Метиловый спирт — сильный яд, поражающий преимущественно нервную систему и кровеносные сосуды. В организм человека он может поступить через дыхательные пути и кожу. Особенно опасен при приеме внутрь. Применение метилового спирта в лабораторной практике допускается только в тех случаях, когда он не может быть заменен другими, менее токсичными веществами.
Синтетический абсолютированный метиловый спирт, выпускаемый промышленностью, содержит лишь следы ацетона и до 0,1% (масс.) воды. В лабораторных условиях его можно приготовить из технического СН3ОН, в котором содержание этих примесей может достигать 0,6 и даже 1,0%. В колбу вместимостью 1,5 л с обратным холодильником, защищенным хлоркальциевой трубкой с CaCl2, помещают 5 г магниевых стружек, заливают их 60-70 мл метилового спирта, содержащего не более 1% воды, прибавляют инициатор — 0,5 г йода (или соответствующее количество метилйодида, этилбромида) и нагревают до растворения последнего. Когда весь магний перейдет в метилат (на дне колбы образуется белый осадок), к полученному раствору прибавляют 800-900 мл технического СН3ОН, кипятят в колбе с обратным холодильником в течение 30 мин, после чего отгоняют спирт из колбы с дефлегматором высотой 50 см, собирая фракцию с температурой кипения 64,5-64,7°С (при нормальном давлении). Приемник снабжают хлоркальциевой трубкой с CaCl2. Содержание воды в полученном таким способом спирте не превышает 0,05% (масс.). Абсолютированный метиловый спирт сохраняют в сосуде, защищенном от влаги воздуха.
Доосушивание метилового спирта, содержащего 0,5-1% воды, можно осуществить металлическим магнием и без инициирования реакции. Для этого к 1 л СН3ОН прибавляют 10 г магниевых стружек и смесь оставляют в колбе с обратным холодильником, защищенным хлоркальциевой трубкой с CaCl2. Реакция начинается самопроизвольно, и вскоре спирт закипает. Когда весь магний растворится, кипение поддерживают нагреванием на водяной бане еще некоторое время, после чего спирт перегоняют, отбрасывая первую порцию дистиллята.
Безводный метиловый спирт получают также, выдерживая его над цеолитом NaA или КА или пропуская через колонку, заполненную этими молекулярными ситами. Для этого можно воспользоваться колонкой лабораторного типа.
Присутствие ацетона в метиловом спирте устанавливают пробой с нитропруссидом натрия. Спирт разбавляют водой, подщелачивают и прибавляют несколько капель свежеприготовленного насыщенного водного раствора нитропруссида натрия. В присутствии ацетона появляется красная окраска, усиливающаяся при подкислении уксусной кислотой.
Для удаления ацетона предложен следующий способ: 500 мл СН3ОН кипятят несколько часов с 25 мл фурфурола и 60 мл 10% раствора NaOH в колбе с обратным холодильником, а затем отгоняют спирт на эффективной колонке. В колбе остается смола — продукт взаимодействия фурфурола с ацетоном.
Бензол
Бензол С6Н6 — бесцветная жидкость; d20-4 = 0,8790; tпл = 5,54 °С; tкип = 80 10°С; n20-D = 1,5011. Бензол и его гомологи — толуол и ксилолы — широко используются в качестве растворителей и среды для азеотропной сушки
Работать с бензолом следует осторожно из-за его горючести и токсичности, а также из-за образования с воздухом взрывоопасных смесей
Пары бензола при многократном воздействии нарушают нормальную функцию кроветворных органов; в жидком состоянии бензол сильно всасывается через кожу и раздражает ее.
Технический бензол содержит до 0,02% (масс.) воды, немного тиофена и некоторые другие примеси.
Бензол образует с водой азеотропную смесь (8,83% (масс.) Н2O) с tкип = 69,25°С. Поэтому при перегонке влажного бензола вода практически полностью отгоняется с первыми порциями дистиллята (мутная жидкость), которые отбрасывают. Как только начнет перегоняться прозрачный дистиллят, можно считать процесс осушения завершенным. Доосушение перегнанного бензола обычно производят прокаленным CaCl2 (в течение 2-3 суток) и натриевой проволокой.
В холодное время года надо следить за тем, чтобы перегоняемый бензол не закристаллизовался в трубке холодильника, омываемой холодной водой (4-5°С).
Бензол и другие углеводороды, высушенные металлическим натрием, гигроскопичны, т. е. могут поглощать влагу.
Товарный технический бензол содержит до 0,05% (масс.) тиофена C4H4S (tкип = 84,12°С; tпл = 38,3°С), который нельзя отделить от бензола ни фракционной перегонкой, ни кристаллизацией (вымораживанием). Тиофен в бензоле обнаруживают следующим образом: раствор 10 мг изатина в 10 мл конц. H2SO4 встряхивают с 3 мл бензола. В присутствии тиофена сернокислотный слой окрашивается в сине-зеленый цвет.
Бензол очищают от тиофена многократным встряхиванием с конц. H2SO4 при комнатной температуре. В этих условиях сульфируется преимущественно тиофен, а не бензол. На 1 л бензола берут 80 мл кислоты. Первая порция H2SO4 окрашивается в сине-зеленый цвет. Нижний слой отделяют, а бензол встряхивают с новой порцией кислоты. Очистку ведут до тех пор, пока не будет достигнуто слабо-желтое окрашивание кислоты. После отделения слоя кислоты бензол промывают водой, затем 10% раствором Na2CO3 и снова водой, после чего бензол перегоняют.
Более эффективный и простой метод очистки бензола от тиофена — кипячение 1 л бензола с 100 г никеля Ренея в колбе с обратным холодильником в течение 15-30 мин.
Еще один способ очистки бензола от тиофена заключается в дробной кристаллизации его из этилового спирта. Насыщенный раствор бензола в спирте охлаждают примерно до -15°С, быстро отфильтровывают твердый бензол и перегоняют.