Применение данных
Полученные данные о количестве нуклонов могут быть применены в различных научных и технических областях. Ниже представлена таблица с некоторыми примерами применения этих данных:
| Область применения | Описание |
|---|---|
| Ядерная физика | Изучение структуры ядра атома, взаимодействия нуклонов и энергетических процессов внутри ядра. |
| Медицина | Определение дозы облучения при проведении радиотерапии или диагностических исследований, контроль радиационной безопасности. |
| Астрофизика | Исследование состава звезд, галактик и космических объектов, изучение ядерных реакций в звездах. |
| Энергетика | Проектирование ядерных реакторов, разработка топлива для ядерных электростанций. |
| Материаловедение | Создание новых материалов с заданными свойствами, исследование структуры и свойств материалов при различных условиях. |
Это только несколько примеров, и применение данных о количестве нуклонов может быть найдено во многих других областях науки и техники.
Определение нуклонов
Существует несколько способов определить количество нуклонов в ядре атома:
1. С помощью протонного номера:
Атомный номер, или протонный номер, обозначает количество протонов в ядре атома. Поскольку протоны и нейтроны имеют примерно одинаковую массу, то общее количество нуклонов можно приближенно определить, исходя из значения атомного номера.
2. С помощью массового числа:
Массовое число — это сумма протонов и нейтронов в атоме. Оно обычно обозначено снизу и справа от химического символа элемента. Зная массовое число, можно узнать общее количество нуклонов в ядре атома.
3. С помощью таблицы элементов:
Таблица элементов химических элементов Менделеева содержит информацию о массовых числах и атомных номерах различных элементов. По ней можно определить общее количество нуклонов в ядре атома.
Зная количество нуклонов в атоме, можно определить его массовое число и другие характеристики, такие как заряд ядра и электронную конфигурацию.
Важно отметить, что количество нуклонов в ядре может варьироваться в зависимости от изотопа элемента. Изотопы имеют одинаковое количество протонов, но разное количество нейтронов
Единственный способ точно определить количество нуклонов в атоме — это провести эксперименты, такие как масс-спектрометрия, которые позволяют определить массу атомов с высокой точностью.
Методы исследования
Определение числа нуклонов может быть произведено с помощью различных методов исследования.
1. Ядерные реакции:
Одним из наиболее распространенных методов является исследование ядерных реакций. При поглощении нуклонов или их выбивании из атомных ядер происходит изменение энергетического состояния ядра. Измерение энергии этих реакций позволяет определить число нуклонов в ядре.
2. Нейтронная резонансная спектроскопия:
Этот метод основан на анализе изменений в энергетическом спектре ядра при пропускании через него потока нейтронов. Измерение изменений пропускной способности в зависимости от энергии нейтронов позволяет определить число нуклонов.
3. Рентгеноструктурный анализ:
Этот метод основан на изучении рентгеновского излучения, рассеянного на атомных ядрах. Анализ угловых распределений рассеянных рентгеновских лучей позволяет получить информацию о распределении нуклонов в ядре.
4. Массовый спектрометрический анализ:
Данный метод основан на измерении массы ядра и анализе массового спектра. Путем сравнения полученных данных с известными значениями можно определить число нуклонов в ядре.
Выбор метода исследования зависит от конкретной задачи и доступных оборудования и технологий.
Изотопы
Изучения атомных ядер показали, что большинство химических элементов представляют собой смесь атомов с одинаковым зарядовым числом, но с различными массами. Атомы с одинаковыми зарядами ядра, но с различными массами назвали изотопами элемента.
Название изотоп произошло от греч. isos — одинаковый, topos — место, т.е. это химические вещества, занимающие одно и то же место в таблице Д.И. Менделеева.
Ядра изотопов отличаются числом нейтронов. Например, водород имеет три изотопа: протий \(~^1_1H\) — ядро состоит из одного протона, дейтерий \(~^2_1H\) — ядро состоит из одного протона и одного нейтрона, тритий \(~^3_1H\) — ядро состоит из одного протона и двух нейтронов. Уран \(~_{92}U\) имеет 12 изотопов с массовыми числами от 228 до 239. Изотопы имеются у всех химических элементов, кроме техниция \(~^{99}_{43}Tc\) и прометия \(~^{141}_{61}Pm\) . В настоящее время известно боле 1900 изотопов. Химические элементы, существующие в природе, представляют собой смеси изотопов. Поэтому атомная масса химического элемента представляет собой среднее значение атомных масс всех его изотопов. Например, у хлора два изотопа с атомными массами 35 и 37, относительное содержание которых 75 и 25%. Поэтому среднее значение атомной массы элемента хлора равно (35·0,75) + (37·0,25) ≈ 35,5.
Ядра отличающиеся по числу нейтронов и протонов
Один и тот же элемент может иметь различные виды атомов или нуклиды (изотопы). Например, ядро хлора может иметь 18 или 20 нейтронов.
Каждый нуклид определяется двумя величинами: количеством протонов Z и количеством нейтронов N. Таким образом, количество нуклонов в нуклиде равно Z + N, оно обозначается символом А и называется массовое (нуклонное) число, ибо определяет массу нуклида.
В настоящее время известно более 1400 нуклидов или изотопов. Количество протонов в видах атома колеблется от 1 до 105. Количество нейтронов от 0 до 157.
Большинство нуклидов радиоактивно, т. е. со временем распадаются, постоянных насчитывается немногим больше 280. Множество их создано искусственно и они нестабильны и распадаются.
Специалисты пользуются так называемой картой нуклидов. Это сеть квадратиков, где на горизонтальной оси дано количество нейтронов N, а на вертикальной — количество протонов Z. Каждому соответствуют две величины (N, Z), то есть один квадрат на карте нуклидов.
Несмотря на большую разнородность атомных ядер или нуклидов, эти системы состоят лишь из двух видов элементарных частиц — из протонов и нейтронов. Они связаны ядерной силой, радиус действия которой только один ферми. Наоборот, электрическая сила протонов существенно превышает радиус действия ядерных сил. Она притягивает электроны и в то же время отталкивает остальные совокупности атомов.
Валентные и неспаренные электроны
Валентные электроны — электроны, способные участвовать в образовании химических связей.
Представим вкусный большой многослойный ягодный торт. Каждый слой — своего рода уровень. На слоях располагаются ягоды, они же электроны. Но самые вкусные (валентные) всегда располагают сверху на торте. То есть валентные электроны могут быть как на внешнем (в качестве украшения торта), так и на предвнешнем (верхнем бисквитном слое) энергетическом уровне.
Поэтому важно научиться определять количество валентных электронов для различных элементов:
- для элементов главных подгрупп — это все электроны внешнего уровня;
- для элементов побочных подгрупп — это электроны внешнего слоя и предвнешнего d-подуровня.
Среди валентных электронов есть как спаренные электроны, так и неспаренные.
Неспаренными называют электроны, которые находятся поодиночке на орбитали атома, соответственно, спаренные — всегда вдвоем.
Например, у атома водорода один неспаренный электрон на внешнем энергетическом уровне, а вот у атома гелия неспаренных электронов уже нет, но так как оба они находятся на внешнем (и в данном случае единственном) энергетическом уровне, они будут валентными.
Запоминалка: существует последовательность чисел, которая позволяет определить количество неспаренных электронов для атомов главных подгрупп: 1-0-1-2-3-2-1-0.
Таким образом, все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными.
Разберем еще один пример задания №1 ЕГЭ по химии.Задание. Определите, атомы каких из указанных в ряду элементов имеют одинаковое количество неспаренных электронов.1) Li 2) Ca 3) N 4) Ne 5) HРешение. Чтобы решить задание, нужно вспомнить последовательность чисел, которая позволяет определить количество неспаренных электроновдля атомов главных подгрупп: 1-0-1-2-3-2-1-0.Li — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ca — элемент IIA группы (1—1-2-3-2-1-0), значит, у него нет неспаренных электронов.N — элемент VA группы (1-0-1-2-3-2-1-0), значит, у него три неспаренных электрона.Ne — элемент VIIIA группы (1-0-1-2-3-2-1-), значит, у него нет неспаренных электронов.H — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ответ: 15
Строение атома — это тема, с которой всегда начинают познание химии, потому что приступать к изучению химических свойств веществ можно только с пониманием поведения элементарных частиц на атомарном уровне. Изучить тему подробнее и разобрать все ее тонкости поможет статья «Особенности строения электронных оболочек атомов переходных элементов».
Экспериментальные методы исследования частиц
Счетчик Гейгера. Камера Вильсона
Ранее был разобран один из способов регистрации альфа-частиц – метод сцинтилляций. Однако он во многом зависит от человеческого фактора – остроты зрения наблюдателя, его внимательности, выносливости и так далее. Для дальнейших исследований строения атомов необходимы были приборы, максимально исключающие человеческий фактор.
Первым из таких приборов стал счетчик Гейгера, названный по фамилии изобретателя.
Данное устройство состоит из двух электродов, помещенных в герметичную стеклянную трубку (СТ), заполненную разреженным газом (как правило, аргоном). Отрицательно заряженный катод (К) представляет собой металлический цилиндр; анод (А) – тонкую проволоку, натянутую вдоль оси цилиндра-катода (см. рисунок 4). Эти электроды через сопротивление R подключены к источнику (U) высокого напряжения (порядка сотен вольт). Между ними возникает сильное электрическое поле.
Рисунок 4 – Схема счетчика Гейгера
Если в стеклянную трубку с газом влетает какая-нибудь частица, способная ионизировать атомы газа (т.е. «выбить» из них свободные электроны), образовавшиеся ионы начинают двигаться под воздействием электрического поля – электроны к аноду, а положительно заряженные – к катоду.
Если напряженность электрического поля большая, то электроны приобретают энергию, достаточную для ионизации других частиц газа в счетчике Гейгера. То есть снова образуются электроны, способные ионизировать другие атомы. В итоге образуется электронно-ионная лавина, которая провоцирует резкое возрастание силы тока в цепи и напряжения на сопротивлении R.В этом и состоит принцип действия счетчика Гейгера: по возрастанию характеристик можно зарегистрировать попавшую в счетчик частицу.
Если взять очень большое сопротивление R, резко возросшее напряжение в сети быстро упадет на этом сопротивлении и прибор будет готов к регистрации новых частиц.
Как правило, счетчик Гейгера использую для регистрации электронов. Данное устройство позволяет зафиксировать только тот факт, что через него пролетела заряженная частица. Для более детального исследования заряженных частиц оно не пригодно.
Более детально изучать частицы позволяет прибор, изобретенный Чарльзом Вильсоном и названный впоследствии камерой Вильсона (см. рисунок 5).
Рисунок 5 – Схема камеры Вильсона
Камера Вильсона состоит из стеклянного цилиндра (СЦ) со стеклянной крышкой (СК). Снизу в цилиндре находится подвижный поршень (ПП), на котором расположена черная ткань, смоченная в смеси воды и этилового спирта. Естественно получается, что воздух в камере наполнен парами воды и этилового спирта. Эту смесь воздуха и паров очищают от различных пылинок, ионов и прочего, на чем пары могли бы конденсироваться.
Если поршень резко отвести вниз, газ в камере расшириться, его внутренняя энергия уменьшится, температура понизится. Если бы смесь была неочищенной, пары воды и этилового спирта сконденсировались бы на примесях – ядрах конденсации (пылинках или ионах), однако их в камере нет. Поэтому газ становится пресыщенным – переходит в неустойчивое состояние, в котором он крайне легко может начать конденсироваться на любой попавшей в него частице, например, ионе.
Действие камеры Вильсона основано на применении способности пресыщенного газа мгновенно конденсироваться на любой попавшей в него частице. Излучаемые частицы влетают в камеру через небольшое отверстие (О) в боковой стенке цилиндра. Они пролетают по газу с большой скоростью, ионизирую его. Образованные ионы становятся ядрами конденсации. Получается, что вдоль всего пути следования частицы возникает след из капелек (он называется трек), который можно увидеть.
Если поместить камеру Вильсона в магнитное поле, которое действует на движущиеся электрические заряды, траектория движения частиц будет искривляться. По ее кривизне можно будет определить массу, энергию и заряд частицы. Возможность определить эти характеристики частиц, является большим преимуществом камеры Вильсона перед счетчиком Гейгера.
Стоит оговориться, что треки существуют в камере крайне недолго, поэтому их, как правило, фотографируют и изучают уже по фотографиям (на схеме Ф – фотоаппарат).
Основные модели
В ядерной физике не существует единой модели, которая бы полностью объясняла все процессы в отдельных ядрах. По сравнению с индивидуальной физикой, где отдельные квантовомеханические модели были успешными, ядра не имеют специального центра масс, а силы между нуклонами намного сложнее, чем чисто электромагнитные взаимодействия индивидов. Поэтому для разных вопросов используются разные базовые модели. Наиболее важными из них являются следующие
- Модель капли ( Карл Фридрих фон Вейцзеккер, 1935, Нильс Бор, 1936) описывает атомное ядро как сферическую каплю электрически заряженной жидкости и дает формулу для ее полной энергии связи. С помощью этой почти классической модели легко объяснить, какие изотопы стабильны, а какие еще можно преобразовать в более прочно связанные посредством высвобождения энергии, например, посредством α-распада, β-распада, деления ядер. Это значит, в том числе. также количество стабильных химических элементов на Земле является оправданием.
- Модель оболочки для ядер ( Maria Гепперт-Майер, Дж Ханс Д. Jensen, 1949) прослеживает структуры атомных ядер по аналогии с оболочечной модели атомной физики чисто квантово — механических законов ( орбитали в потенциальной яме, принцип Паули ). Взаимодействие между двумя нуклонами рассматриваются только в дальнейшем уточнении. Оболочечная модель может объяснить отклонения от модели капли с точки зрения энергии связи ядер, в частности высокой стабильности с определенными так называемыми магическими числами протонов и нейтронов. Он также предоставляет подробные объяснения уровней энергии, ядерных спинов, магнитных моментов, механизмов ядерных реакций, поскольку они являются результатом движения одного или очень небольшого числа нуклонов в ядре. Однако часто возбужденные состояния атомного ядра образуются с участием многих или даже всех нуклонов.
- Коллективная модель ( Оге Нильс Бор, Бен Моттельсон, 1953) используется для деформированных ядер для описания коллективных возбуждений (колебаний и вращений). Эти ядра не имеют точной сферической формы, а слегка приплюснуты в одном направлении или несколько вытянуты, что видно, например, по электрическим квадрупольным моментам этих ядер. В результате получается характерная схема уровней возбужденных состояний в виде полосы колебаний или полосы вращения.
- В единой модели ( Джеймс Рейнуотер, 1957) модель оболочки и коллективная модель объединены.
Другими частично очень упрощенными моделями или моделями, которые рассматриваются для конкретных целей, являются, например, следующие
- Модель Фермигаза (также единая модель ). Здесь предполагается, что нуклоны свободно перемещаются, несмотря на их сильные взаимодействия, и подчиняются только принципу Паули. Эта идея используется в модели капли энергии связи для обоснования энергии асимметрии , которая описывает влияние отношения числа нейтронов к числу протонов.
- Модель альфа-частиц . Альфа-частицы здесь представляют собой стабильные субъединицы внутри ядра, которое z. Б. для сердечников C-12, O-16, Ne-20 дает полезное модельное представление.
- Модель потенциальной скважины . Здесь, по аналогии с атомом, задан некоторый потенциал, из которого определяется спектр естественных энергетических состояний отдельного нуклона. Это основа оболочечной модели и пространственно ограниченной модели Фермигаза. Простой коробчатый потенциал, осцилляторный потенциал и значительно более реалистичный потенциал Вудса-Саксона являются основными формами потенциала.
- Оптическая модель . Здесь ядерные реакции моделируются в том смысле, что на падающий снаряд воздействует ядро цели так же, как на световую волну воздействует поглощающая («облачная») линза. Модель хорошо подходит для упругого рассеяния, а также для реакций, в которых только частица отрывается от ядра мишени или добавляется к нему.
- Модель взаимодействующих бозонов. Здесь нуклоны вне замкнутой оболочки сначала объединяются в пары протонов или нейтронов, а на следующем этапе моделируются их взаимодействия.
Открытия протона и нейтрона
Первую частицу, входящую в состав атомных ядер, открыл в 1919 г. Э. Резерфорд, исследуя взаимодействие α-частиц с ядрами атомов азота.
В герметический сосуд помещался источник α-частиц, перед которым располагался прозрачный экран, покрытый сульфидом цинка. При выкачивании воздуха из сосуда, α-частицы достигали экрана и вызывали световые вспышки, наблюдаемые с помощью микроскопа. Источник частиц отодвинули от экрана настолько, что вспышек на экране не было видно, т.е. α-частицы не долетали до экрана. При заполнении сосуда газообразным азотом, на экране наблюдались световые вспышки. Так как электроны не способны вызвать световую вспышку, видимую в микроскоп, то следовательно, α-частицы из ядер азота выбивали какие-то другие заряженные частицы.
Исследования действия электрических и магнитных полей на частицы, выбиваемые из ядер азота, показали, что эти частицы обладают положительным элементарным зарядом и масса их равна массе ядра водорода. Эти частицы — ядра атомов водорода — назвали протонами. Обозначим протон \(~^1_1H\) или \(~^1_1p\) , тогда данную реакцию можно записать так\. Продолжая опыты с бором, фтором, натрием и рядом других элементов, Э Резерфорд обнаружил, что α-частица выбивает и из этих ядер протоны. На этом основании можно сделать вывод, что ядра атомов всех элементов содержат протоны.
В 1930 г. немецкие ученые В. Боте и Г. Беккер обнаружили, что при облучении бериллия α-частицами, возникает излучение неизвестной природы, способное проходить через толстые слои свинца с меньшим ослаблением, чем даже рентгеновское или γ-излучение. Боте и Беккер решили, что они получили очень жесткие γ-лучи.
В 1932 г. французские ученые Ф. и И. Жолио-Кюри решили изучить излучение, получаемое при облучении бериллия α-частицами. Прежде всего они выяснили, что эти лучи почти не ионизуют воздух, через который проходят. Но если на их пути поместить парафин, то ионизирующая способность лучей резко возрастает. Они предположили, что это излучение выбивает из парафиновой пластины протоны, имеющиеся в большом количестве в этом водородосодержащем веществе.
В том же 1932 году, английский физик Д. Чедвик (сотрудник Э. Резерфорда) выдвинул предположение, согласно которому при облучении бериллия α-частицами излучаются не γ-лучи, а поток нейтральных частиц с массой, примерно равной массе протона. Гипотезу о существовании такой нейтральной частицы с массой, примерно равной массе протона, еще в 1920 г. высказал Резерфорд, он же и дал название предполагаемой частице — нейтрон .
Название нейтрон произошло от лат. neutron — ни тот, ни другой, т.е. не имеющий ни положительного, ни отрицательного заряда.
Обозначается нейтрон \(~^1_0n\) . Опыты Чедвика явились экспериментальным доказательством существования нейтронов.
Способ 3: Измерение массы атома
Для измерения массы атома используются различные методы, но один из наиболее точных способов — это масс-спектрометрия. В процессе масс-спектрометрии, ионы атомов или молекул разделяются по их массе с помощью магнитного поля или электрического заряда.
После разделения ионов, они собираются в детекторе, который регистрирует количество ионов каждого типа. Зная отношение массы протона и массы нейтрона, можно вычислить количество нуклонов в ядре атома.
Масс-спектрометрия имеет высокую точность и позволяет определить массу атома с большой точностью. Этот метод широко используется в современных лабораториях и научных исследованиях для определения состава и структуры атомов и молекул.
| Протон | Нейтрон | Электрон |
|---|---|---|
| Масса: 1,00727647 u | Масса: 1,00866492 u | Масса: ~0,00054858 u |
Модель Шрёдингера и одноэлектронные атомы
Для одноэлектронных атомов, то есть атомов, в которых содержится только один электрон, модель Шрёдингера представляет собой формулу, решение которой дает функцию волновой функции, описывающую состояние электрона.
Такая волновая функция зависит от трех координат: радиуса, угловой координаты и угла между электроном и зоной однородного поля, и называется сферической функцией. Энергетические уровни электрона определяются значениями квантовых чисел — главного, орбитального и магнитного.
Модель Шрёдингера позволяет определить вероятность нахождения электрона в каждой области пространства вокруг ядра. Эта информация важна, например, для определения радиуса атома и формирования электронной оболочки. Обобщая результаты для многих одноэлектронных атомов, можно определить общую закономерность: число нуклонов (протонов и нейтронов) в ядре атома равно порядковому числу последнего заполненного энергетического уровня.
Радиоактивность как свидетельство сложного строения атомов
Альфа-, бета-, гамма-частицы. Излучение
В конце 19-го века французский ученый Анри Беккерель обнаружил, что химический элемент уран излучает невидимые лучи неизвестной природы. Причем делает он это самопроизвольно (без воздействия извне). Это явление было названо радиоактивным излучением или просто явлением радиоактивности.
Так как явление было новое и необычное, за его изучение взялись многие ученые. Скоро было открыто, что явление радиоактивного излучения было присуще не только урану, но и другим химическим элементам (например, радию).
Способность атомов к самопроизвольному излучению назвали радиоактивностью.
Э. Резерфорд для изучения явления радиоактивности провел следующий опыт (см. рисунок 1а): небольшое количество радия (Р) помещалось в толстостенный свинцовый сосуд с отверстием в крышке (С). Радиоактивные лучи в таком случае не могут пройти сквозь стенки сосуда, но могут через отверстие – получается направленный пучок излучения (П). Напротив отверстия располагали фотопластинку (Ф). При проявлении фотопластинки место, куда попадал пучок излучения (напротив отверстия), выглядело как темное пятно.
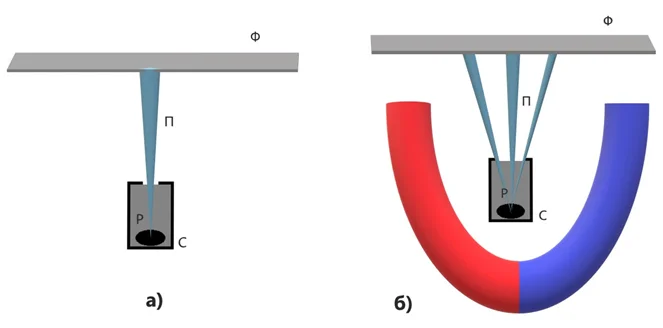 Рисунок 1 – Схема опыта по изучению радиоактивности
Рисунок 1 – Схема опыта по изучению радиоактивности
Затем на пути следования пучка излучения создавали магнитное поле (см. рисунок 1б). На фотопластинке в таком случае появлялось не одно, а три пятна – одно на прежнем месте (напротив отверстия) и два по бокам от него. Как известно, магнитное поле действует на движущиеся заряды. Более того, если два потока отклонились в разные стороны, значит это были потоки частиц разных знаков – положительных и отрицательных.
Получается, что поток излучения радия состоит из трех компонентов:
- излучение, имеющее в своем составе положительно заряженные частицы;
- излучение с отрицательно заряженными частицами;
- излучение, не имеющее заряда (центральное пятно).
Положительно заряженные частицы, входящие в состав излучения, назвали альфа-частицами (иногда пишут α-частицы). В ходе дальнейших исследований было выяснено, что они представляют собой ионизированные атомы гелия 2+. То есть заряд альфа-частицы положителен и по модулю вдвое больше элементарного электрического заряда.
Отрицательно заряженные в составе излучения были названы бета-частицами (β-частицами). Они представляют собой поток электронов . То есть бета-частица имеет заряд (-1) – отрицательный и равный по модулю элементарному электрическому заряду.
Нейтральное излучение назвали гамма-частицами или гамма-квантами (γ-частицы или γ-кванты). Оно представляет собой один из видов электромагнитного излучения.
Так как до всех этих открытий уже было известно, что атом электрически нейтрален, а в опытах по исследованию радиоактивности оказалось, что электрически нейтральные атомы испускают положительно и отрицательно заряженные альфа- и бета-частицы, ученые сделали вывод, что все атомы состоят из заряженных частиц.
Упражнение 48
1. Сколько нуклонов в ядре атома бериллия Сколько в нём протонов; нейтронов?
2. Для атома калия определите: а) зарядовое число; б) число протонов; в) порядковый номер в таблице Д. И. Менделеева; г) число нуклонов; д) число нейтронов.
3. Определите с помощью таблицы Д. И. Менделеева, атом какого химического элемента имеет: а) 3 протона в ядре; б) 9 электронов.
4. При α-распаде исходное ядро, излучая α-частицу , превращается в ядро атома другого химического элемента.
Например,
На сколько клеток и в какую сторону (к началу или к концу таблицы Д. И. Менделеева) смещён образовавшийся элемент по отношению к исходному?
Перепишите в тетрадь данное ниже правило смещения для α-распада, заполнив пропуски:
при α-распаде одного химического элемента образуется другой элемент, который расположен в таблице Д. И. Менделеева на … клетки ближе к её …, чем исходный.
5. При β-распаде исходного ядра один из входящих в это ядро нейтронов превращается в протон, электрон и антинейтрино (частицу, легко проходящую сквозь земной шар и, возможно, не имеющую массы). Электрон и антинейтрино вылетают из ядра, а протон остаётся в ядре, увеличивая его заряд на единицу.
Например,
Перепишите данное ниже правило смещения для β-распада, заполнив пропуски:
при β-распаде одного химического элемента образуется другой элемент, который расположен в таблице Д. И. Менделеева на … клетку ближе к … таблицы, чем исходный.
6. Как вы думаете, действуют ли между нуклонами в ядре силы гравитационного притяжения (т. е. силы всемирного тяготения)? Ответ обоснуйте.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
∆m=(Zmp+Nmn)-Mя
где Mя– масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp– масса протона, mn– масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
(0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
(0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Как определяется энергия связи атомного ядра
Для расчета энергии связи используют формулу, полученную А. Эйнштейном:
Энергия связи измеряется в электронвольтах (эВ), но из-за больших значений чаще используют единицу мегаэлектронвольт (МэВ).
На практике часто используют удельную энергию связи — f. Удельная энергия связи показывает, какую энергию приходится затратить на отрыв одного нуклона от ядра.
Удельную энергию связи можно рассчитать по формуле:
Атомы с порядковыми номерами больше 80–83 являются радиоактивными. В ядрах таких атомов кулоновские силы не могут в полной мере подавляться ядерными силами, в результате нестабильное ядро превращается в «дочерние» ядра с испусканием частиц. Вновь образовавшиеся ядра с одинаковым порядковым номером, но разными массовыми числами называются изотопами.
В настоящее время оба процесса (реакция деления и термоядерный синтез) реализованы практически.
Оглавление
Размер, плотность, компоненты, названия
Ядро человека находится, говоря простым языком, в центре человека — его диаметр составляет примерно 1 /20 000 1 / к150 000 по. диаметра электронной оболочки. Атомное ядро имеет z. B. диаметр около 1 фм (фемтометр), а небесный диаметр — около 16 фм. В зависимости от элемента, его ядро составляет 99,95-99,98 процента от общей массы.
Плотность ядра (отношение массы ядра к его объему) примерно одинакова для всех ядер и составляет от около 2 до 10 17 кг/м³. Материалы с такой плотностью называются ядерными материалами. Например, чтобы достичь такой плотности, пирамиду HEOPA пришлось сжать до размера перца.
Ядро состоит из протонов и нейтронов, которые имеют примерно одинаковую массу и вместе называются нуклонами. Число протонов называется атомным номером и обычно обозначается символом. (Общее число нуклонов называется массой, а число нейтронов обозначается символом, более подробную информацию о массе ядра см. в разделе «Масса ядра или неполная масса»). Количество людей, найденных естественным образом на Земле, колеблется от (1 ч. нормального водорода) до 244 (244 ПУ). С другой стороны, макроскопическая плотность обогащенной материи не увеличивается пропорционально индивидуальным массам, поскольку атомные радиусы также увеличиваются в среднем в 3-4 раза (см. индивидуальные радиусы, за исключением сильных циклических вариаций). Z A. N A. Синус равен Z + N A. Синус равен 1
Протоны заряжены положительно, а нейтроны — нейтрально. Поэтому атомное ядро заряжено положительно и может связывать отрицательно заряженные электроны благодаря кулоновским силам. Поскольку нагрузка электронов и протонов обратно пропорциональна, электрически нейтральный человек имеет столько же электронов в атомной оболочке, сколько протонов в ядре. Поскольку атомная оболочка в основном определяет химические свойства, атомный номер также определяет, к какому элементу принадлежит индивид.
Количество нейтронов незначительно влияет на химические свойства, но существенно для стабильности или нестабильности (радиоактивности) ядра. Помимо спонтанного радиоактивного распада, количество протонов или нейтронов в ядре может изменяться только в результате ядерных реакций. То есть в результате столкновения ядра с другим ядром или другой частицей.
Тип человека или ядра, определяемый его количеством атомов и массой, называется нуклеидом. Ядра GG включают оба масштабных ядра, ядро UU и два ядра нуклидов, а также ядро UG или GU и два линейных ядра. Если изомеры являются ядрами при определенных уровнях стимула (см. ниже), они считаются собственными ядрами. Когда мы различаем ядра (или целые ядра) одного и того же элемента, то есть с одинаковым числом протонов и по числу нейтронов, мы говорим об изотопах соответствующего элемента. Нуклеиды характеризуются химическими символами и массовыми числами. B. Наиболее распространенный изотоп углерода 12 C или наиболее распространенный изотоп железа 56 Fe (с изомерами с добавлением «переходного» типа «M»). Реже встречаются названия C-12 или FE-56 или ненужное дополнительное указание номера заказа. Z n z n 26th 56th Fe. e _ ^^ \ mathrm>
Всего известно около 3200 макробионтных нуклеидов (с 2003 года), распределенных между примерно 2700 изотопами и 118 известными элементами — от водорода до онканов. В их составе имеется около 250 постоянных изотопов. Ядерная стабильность зависит от количества протонов и нейтронов. Если эти два числа выходят за пределы определенного диапазона, то ядро нестабильно. Он радиоактивен и преобразуется в более стабильное ядро. Для протонов с номерами выше 43, 61 и 82 фиксированное ядро отсутствует.