Применение
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена (наиболее крупнотоннажный полимер в мировом производстве). В зависимости от условий полимеризации получают полиэтилены низкого давления и полиэтилены высокого давления.
Также полиэтилен применяют для производства ряда сополимеров, в том числе с пропиленом, стиролом, винилацетатом и другими. Этилен является сырьем для производства окиси этилена; как алкилирующий агент – при производстве этилбензола, диэтилбензола, триэтилбензола.
Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
Примеры бескислородных кислот
Бескислородные кислоты, также известные как гидридокислоты, являются типом кислот, которые не содержат кислорода в своей структуре. Они образуются путем сочетания водорода с различными элементами, такими как водород, азот и сера.
Вот некоторые примеры бескислородных кислот:
- Гидроксид водорода (водная серная кислота): Химическая формула этой кислоты H2SO4. Она широко используется в промышленности для производства удобрений, пластмасс и других химических веществ.
- Гидроксид аммония (водная аммиачная кислота): Химическая формула этой кислоты NH4OH. Она используется в качестве щелочного растворителя, а также в качестве основного компонента чистящих средств.
- Гидроксид натрия (водная щелочная кислота): Химическая формула этой кислоты NaOH. Она широко применяется в химической и фармацевтической промышленности для производства различных продуктов, включая мыло и стекло.
Это всего лишь некоторые примеры бескислородных кислот, которые используются в различных отраслях. Надеюсь, это помогло вам лучше понять этот тип кислот.
Соляная кислота
Соляная кислота (хлороводородная кислота) — это безцветная жидкость, являющаяся одной из самых распространенных и важных двухосновных кислот.
Состоит из двух элементов — хлора и водорода — и имеет химическую формулу НСl. Кислота образуется при растворении газообразного хлороводорода в воде.
Соляная кислота является одной из кислородосодержащих кислот, то есть содержит атом кислорода в своей формуле. Она обладает выраженными кислотными свойствами и может реагировать с основаниями, образуя соли и воду.
Соляная кислота применяется в различных отраслях промышленности, таких как химическая, нефтеперерабатывающая и металлургическая промышленность. Она используется также в лабораторной практике, в бытовых целях (например, для очистки и дезинфекции), а также в медицине для некоторых медицинских процедур.
Важно помнить, что соляная кислота относится к веществам, которые могут быть опасными при неправильном использовании
При работе с ней необходимо соблюдать меры предосторожности и использовать соответствующие защитные средства
Хлороводородная кислота
Хлороводородная кислота (HCl) является бескислородной кислотой, так как не содержит кислород. Она состоит из хлора и водорода и образует сильное электролитное соединение.
Хлороводородная кислота является одноосновной кислотой, так как в ее молекуле есть только одна кислородосодержащая группа. Кислота реагирует с веществами, обладающими основными свойствами.
Хлороводородная кислота обладает выраженными кислотными свойствами. Она реагирует с основаниями, оксидами и гидроксидами, образуя соли и воду. Например, реакция хлороводородной кислоты с гидроксидом натрия приводит к образованию натрия хлорида и воды:
HCl + NaOH → NaCl + H2O
Хлороводородная кислота обладает также амфотерными свойствами, то есть может реагировать как с кислотными, так и с основными веществами. Например, она реагирует с водой образуя ион гидроксония и ион хлорида:
HCl + H2O ⇌ H3O+ + Cl—
Хлороводородная кислота является токсичным и едким веществом. Она является основным компонентом желудочного сока и играет важную роль в пищеварении.
В промышленности хлороводородная кислота широко применяется в химических процессах, например, для очистки металлов от окислов или в процессах синтеза различных химических соединений.
Фтороводородная кислота
Фтороводородная кислота (HF) — это бесцветная, едкий растворитель, обладающая сильными кислотными свойствами. Она является одноосновной кислотой, то есть в ее составе содержится только одна кислотная группа.
Фтороводородная кислота относится к кислородосодержащим кислотам, так как ее состав включает атомы кислорода. Однако, она отличается от других кислот, так как не содержит кислорода-водорода.
Фтороводородная кислота имеет молекулярную формулу HF и образуется при соединении молекулы фтора (F2) с молекулой воды (H2O).
Основные свойства фтороводородной кислоты:
- Едкость: HF обладает высокой едкостью, что означает, что она может вызывать ожоги на коже и повреждение тканей. Необходимо быть осторожным при работе с этой кислотой.
- Кислотность: Фтороводородная кислота относится к самым сильным кислотам. Она может реагировать с основаниями и образовывать соли.
- Органические свойства: HF способна реагировать с органическими веществами, вызывая их разложение.
Фтороводородная кислота широко используется в различных отраслях промышленности, включая химическую, стекольную, нефтяную и электронную промышленность. Ее применяют, например, в процессе производства пластика, стекла, а также в химическом анализе и лабораторных исследованиях.
Общая характеристика
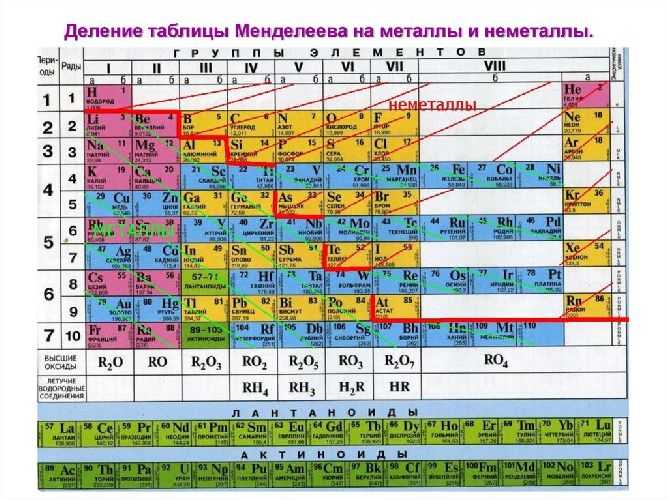
К неметаллическим элементам относятся p-элементы, а также водород и гелий, которые в свою очередь относятся к s-элементам. Они расположены правее и выше диагонали бор-астат. Всего же известно 22 неметалла. У наиболее типичных неметаллов заполнение электронами внешнего уровня близко к максимальному, а радиусы атомов – минимальные среди элементов данного периода.
Рис. 1. Группа неметаллов в периодической системе.
Атомы неметаллов имеют более высокие значения электроотрицательности, а соответственно высокие энергии ионизации и большое сродство к электрону. В связи с этим характер неметаллов таков, что, в отличии от металлов, могут проявлять окислительные свойства. В реакциях они могут восстанавливаться, присоединяя столько электронов, чтобы общее их количество на внешнем уровне достигло восьми (завершенный уровень, стабильное состояние атома).
Особенности строения неметаллов заключаются в том, что внешний электронный слой у большинства атомов неметаллов содержит от 4 до 8 электронов.
Другие неметаллы (кроме фтора) могут проявлять и положительные степени окисления, образуя ковалентные связи с другими элементами.
Значение одноосновных и двухосновных кислот в промышленности и повседневной жизни
Одноосновные и двухосновные кислоты играют важную роль как в промышленности, так и в повседневной жизни. В данном разделе мы рассмотрим основные области, в которых эти кислоты находят свое применение.
Одноосновные кислоты
Одноосновные кислоты, такие как серная кислота (H2SO4), являются одними из самых важных продуктов химической промышленности. Они используются в производстве множества товаров и материалов.
Производство удобрений: серная кислота используется для производства суперфосфата — важного компонента минеральных удобрений.
Нефтехимическая промышленность: серная кислота используется для получения сульфообразующих агентов, которые затем применяются в процессе очистки нефти и газа.
Производство аккумуляторов: серная кислота используется для наполнения аккумуляторов автомобилей.
Производство резин: серная кислота применяется при вулканизации резины, что повышает ее прочность и упругость.
Кроме серной кислоты, одноосновные кислоты, такие как соляная кислота (HCl) и азотная кислота (HNO3), также находят свое применение в ряде отраслей промышленности:
- Производство пищевых добавок: соляная кислота используется для получения мононатриевой глутамата, который широко применяется в пищевой промышленности как усилитель вкуса.
- Производство удобрений и взрывчатых веществ: азотная кислота используется в производстве аммиачной селитры и других азотных удобрений, а также в изготовлении взрывчатых веществ.
Двухосновные кислоты
Двухосновные кислоты также имеют важное значение в различных сферах промышленности и повседневной жизни
- Производство удобрений: фосфорная кислота (H3PO4) используется для производства фосфорных удобрений, таких как аммиачная фосфатная селитра и суперфосфаты.
- Производство моющих средств: многие двухосновные кислоты, например, лимонная кислота (C6H8O7), используются в производстве моющих средств и косметических продуктов.
- Производство пищевых продуктов: лимонная кислота используется в пищевой промышленности в качестве консерванта, а также для придания кислотности и аромата различным продуктам.
Таким образом, как одноосновные, так и двухосновные кислоты широко применяются в различных областях промышленности и повседневной жизни. Их значения варьируют от производства химических соединений до производства пищевых продуктов и добавок, что делает их неотъемлемой частью современного мира.
Применение, польза и вред
Кислоты в наше время находят широкое применение в самых разных областях человеческой деятельности, они являются компонентами некоторых лекарств, а также сельскохозяйственных удобрений, их используют для очистки нефтепродуктов, при производстве красителей, моющих веществ, а также взрывчатки.
К слову о взрывчатке, ее ведь не только в военных целях делают, но и мирных, например Альфред Нобель, создатель динамита изначально свое изобретение делал для того, чтобы строителям было легче прокладывать туннели в горах. Ну а потом уже военные нашли этому изобретению свое разрушительное применение. А в основе устройства динамита напомним, лежит взрывчатое вещество нитроглицерин, состоящий из глицерина и азотной кислоты.
Уксусная и лимонная кислоты активно используются в кулинарии, при помощи щавелевой кислоты можно легко выводить пятна и ржавчины, разбавленная соляная кислота в небольшой концентрации полезна при лечении некоторых заболеваний желудочно-кишечного тракта, а борная кислота будет незаменимой, если необходимо избавится от тараканов и домовых муравьев.
Одним словом кислоты могут быть весьма полезными для человека, но с другой стороны не стоит забывать и о той опасности, которую они таят. Некоторые кислоты, например серная и азотная при попадании на кожу человека могут вызвать химические ожоги. Также некоторые особенно сильные кислоты, использующиеся в производстве (особенно металлургии), например плавиковая кислота, способная растворять даже стекло, опасна для человека даже своими ядовитыми парами
Поэтому при работе с такими кислотами очень важно соблюдать необходимую технику безопасности
Схожі записи:
Рифы и мели ледяной химии
Где заканчивается система Менделеева
Мясо, химия и микробы
Ядерная космохимия
Вторжение химотронов
Применение и значение
Двухосновные кислоты широко применяются в различных областях науки и промышленности. Их свойства и взаимодействие с веществами играют важную роль в многих процессах и явлениях.
В медицине двухосновные кислоты используются для создания лекарственных препаратов. Они могут служить основой для синтеза различных лечебных соединений, таких как антибиотики, анальгетики, антисептики и противозачаточные средства. Кислоты также используются для регулирования pH в биологических средах и процессах.
В химической промышленности двухосновные кислоты находят широкое применение в процессах производства различных веществ. Они могут служить катализаторами, ингибиторами или растворителями. Кроме того, кислоты используются в производстве удобрений, пластмасс, красителей, растворителей, а также в процессах очистки воды и сточных вод.
В пищевой промышленности двухосновные кислоты используются в качестве консервантов и добавок, обладающих кислотной или антиоксидантной активностью. Они могут использоваться для создания вкусовых добавок и ароматизаторов, а также для регулирования pH и стабилизации продуктов питания.
В электротехнике и электронике двухосновные кислоты играют важную роль в процессах производства и обработки полупроводников, а также в создании аккумуляторных батарей. Они также используются в процессах гальванического покрытия металлов и удаления оксида меди с поверхности электрических контактов.
В сельском хозяйстве двухосновные кислоты могут использоваться в процессе обработки почвы, улучшения ее качества и повышения урожайности. Кислоты также применяются в качестве компонентов удобрений и хелатирующих агентов для повышения усвояемости питательных веществ растениями.
В целом, двухосновные кислоты играют важную роль во многих отраслях науки и промышленности. Их свойства и взаимодействие с веществами позволяют использовать их для создания новых материалов, лекарственных препаратов и технологий, что способствует развитию и совершенствованию различных областей и отраслей деятельности.
Определение кислородосодержащих кислот

Возможно, вы слышали о таких кислотах, как уксусная, лимонная или салициловая. Они все относятся к классу кислородосодержащих кислот и имеют свои особенности и применения. Что делает их особенными? Давайте разберемся!
Кислородосодержащие кислоты обладают рядом химических свойств, которые делают их кислотами. Главное из них — наличие карбоксильной группы, состоящей из одного атома углерода, двух атомов кислорода и одного атома водорода (COOH). Эта группа дает кислотам их характерный кислый вкус и способность образовывать соли при реакции с основаниями.
- Карбоновые кислоты, к которым относится уксусная кислота, являются одним из наиболее распространенных классов кислородосодержащих кислот. Они имеют множество применений в промышленности и быту, например, в пищевой отрасли, фармацевтике и производстве растворителей.
- Гидроксикислоты, такие как лимонная и молочная, содержат гидроксильную группу (OH) вместо одного из атомов кислорода в карбоксильной группе. Эти кислоты обладают кислым вкусом и часто используются в пищевой промышленности как консерванты и ароматизаторы.
- Фосфорные кислоты, такие как ортофосфорная или пирофосфорная, содержат фосфатные группы (PO4) вместо карбоксильной группы. Они широко используются в химической промышленности и сельском хозяйстве в качестве удобрений и стабилизаторов.
Кроме того, кислородосодержащие кислоты могут служить важными метаболическими молекулами в организмах живых существ. Например, аминокислоты, основные строительные блоки белков, имеют карбоксильные группы и являются кислотами. Они играют роль в регуляции обмена веществ и транспорте кислорода.
Таким образом, кислородосодержащие кислоты представляют собой разнообразный класс органических соединений, которые играют важную роль в нашей повседневной жизни и химической науке. Их свойства и применения делают их неотъемлемой частью нашего окружающего мира. Возможно, теперь вы будете обращать больше внимания на эти кислородосодержащие соединения и видеть их везде, от продуктов питания до лекарственных препаратов.
Понятие кислота
В 1877 году химик из Швеции Сванте Аррениус предложил разделять ряд веществ на основания и кислоты. Согласно его теории, если при растворении в воде элемент высвобождает протон водорода Н+, его нужно относить к кислоте, а если гидроксид-иона (ОН-), то к основанию. Это правило позволило объяснить нейтрализацию веществ при взаимодействии друг с другом. Позже учёный дал уточнение, что сталкивание гидроксид-иона с ионом водорода образовывает воду H2O.

В начале двадцатого века британец Томас Лаури и датчанин Йоханнсен Брёнстед расширили определение. Они предложили относить к кислотам любую молекулу (ион), способную отдавать протон. Это позволило описать реакции, проходящие c водой, например, хлорид аммония.
В 1923 году американец Льюис на основании двух определений сформулировал своё правило. Его формулировка и стала использоваться повсеместно. По нему, кислота — это химическое соединение, принимающее электронную пару и образовывающее ковалентную связь. Основание же, напротив — соединение, способное избавляться от электронной пары.
Все кислоты в химии принято разделять на 2 типа:
- Кислородосодержащие;
- Бескислородные.
Кроме этого, соединения могут быть одноосновными, двухосновными или трёхосновными. Все кислоты, за исключением кремниевой, отлично растворяются в воде. При взаимодействии с основаниями образуют соль, воду и кислотный остаток. Протекание реакции при соприкосновении с металлами происходит не всегда. Взаимодействие возможно лишь элементов, которые располагаются левее водорода. При этом кислотное соединение должно быть не только сильным, но и способным отдавать частицы водорода, которые выделяются во время взаимодействия.
Кислотные растворы могут изменять цвет. Так, лакмус становится красным. Соединение при взаимодействии имеет кислый вкус, появляется электрическая проводимость.
Номенклатура
Систематические наименования бескислородных кислот строятся по следующему правилу: название элемента + суффикс «-о-» + «-водородная» (бромоводородная HBr ).
Наименование кислородсодержащей кислоты определяют особенности состава:
Степень окисления кислотообразующего элемента:
| высшая | название элемента + суффикс «-н-», «-ов-», «-ев-» | |
| промежуточная +5 | название элемента + суффикс «-оват-» | |
| промежуточная +3, +4 | название элемента + суффикс «-ист-», «-овист-» | |
| +1 | название элемента + суффикс «-оватист-» |
Содержание кислорода:
| выше | приставка «орто-» + название кислоты | |
| ниже | приставка «мета-» + название кислоты |
Нуклеиновые кислоты
Нуклеиновые кислоты – это класс кислот, представленных генетическими молекулами ДНК и РНК. Они играют фундаментальную роль в передаче и хранении генетической информации в живых организмах.
Дезоксирибонуклеиновая кислота (ДНК) является основным носителем наследственной информации. Она состоит из двух взаимосвязанных цепей нуклеотидов, связанных восстановляемой гидрогенной связью. ДНК имеет двойную спиральную структуру, где каждая цепь завершается концами 3′- и 5′-.
Рибонуклеиновая кислота (РНК) включает несколько разных видов молекул, которые выполняют разные функции в клетке. РНК обеспечивает транскрипцию генетической информации и участвует в процессе перевода кода ДНК в белок. РНК также играет роль структурных элементов клеток и участвует в регуляции генной экспрессии.
Нуклеиновые кислоты имеют сложную структуру, состоящую из нуклеотидов. Нуклеотиды состоят из пуринового или пиримидинового основания, сахара (деоксирибоза для ДНК и рибоза для РНК) и фосфатной группы.
Основными представителями нуклеиновых кислот являются:
- Дезоксирибонуклеиновая кислота (ДНК) – основной носитель генетической информации у всех организмов.
- Рибонуклеиновая кислота (РНК) – выполняет различные функции внутри клетки, такие как транскрипция и трансляция генетической информации.
Свойства нуклеиновых кислот:
- ДНК имеет двойную спиральную структуру, а РНК обычно одноцепочечная.
- Нуклеиновые кислоты содержат пуриновые и пиримидиновые основания, которые определяют последовательность генетической информации.
- Нуклеотиды в нуклеиновых кислотах соединены восстановляемой гидрогенной связью.
- Нуклеиновые кислоты могут образовывать комплементарные пары (А — Т, Г — Ц в ДНК, и А — У, Г — Ц в РНК).
- Нуклеиновые кислоты могут быть участвовать в полимеразной цепной реакции (ПЦР) и секвенировании, что позволяет изучать генетическую информацию.
Нуклеиновые кислоты являются основой нашего генетического кода и играют ключевую роль в развитии и функционировании организмов.
Роль двухосновной кислоты в организме
Двухосновная кислота играет важную роль в организме, участвуя в множестве биологических процессов. Одно из основных свойств двухосновной кислоты — ее способность нейтрализовать щелочные соединения
Это значит, что она может помочь поддерживать оптимальный уровень pH в организме, что крайне важно для его нормальной работы
Другая важная роль двухосновных кислот заключается в участии в регуляции электролитного баланса. Они способны связывать ионизированные формы различных веществ и помогать поддерживать необходимые концентрации электролитов в клетках и внеклеточной жидкости. Это в свою очередь позволяет обеспечить правильное функционирование множества биохимических процессов.
Также двухосновные кислоты участвуют в процессе синтеза белков, являясь важными компонентами аминокислотных цепочек. Они помогают образовывать связи между аминокислотами, что необходимо для создания структурных элементов белков. Без участия двухосновных кислот было бы невозможно правильное функционирование всех белков, которые являются основными строительными блоками организма.
Общие свойства
Во-первых, следует помнить, что все кислоты являются сложными химическими соединениями, состоящими из нескольких химических элементов.
Во-вторых, характерной отличительной чертой практически всех кислот является наличие атомов водорода H. Помимо водорода кислота состоит из кислотного остатка, например, самая популярная серная кислота имеет формулу – H2SO4, То есть первая часть формулы кислоты всегда состоит из водорода, затем идет собственно кислотный остаток.
Но в этом правиле есть исключение, это так называемые кислоты Льюиса, апротонные кислоты, без водорода. Правда кислотами они являются тоже условно, дело в том, что в химии есть несколько теорий кислот, согласно одно из них, предложенной американским физикохимиком Г. Н. Льюисом, кислотой является всякое химическое соединение, способное принять пару электронов соединения-донора. Поэтому кислотами согласно Льюису, могут считаться молекулы с незаполненной восьмиэлектронной оболочкой, а также катионы металлов-комплексообразователей, галогениды переходных металлов, молекулы с полярными двойными связями и карбокатионы.
Классификация кислот
Кислоты делятся на две группы:
- неорганические;
- органические.
Неорганические кислоты имеют общую формулу HnK, где K — кислотный остаток. Классифицируют их по нескольким показателям:
- Наличие кислорода в кислотном остатке: кислородсодержащие (H3PO4, HNO3) и бескислородные (H2S, HCl).
- Основность (количество атомов водорода, способных заместиться на металл): одноосновные (HBr, HNO3), двухосновные (H2SO4, H2CO3), трехосновные (H3PO4).
- Летучесть: летучие (H2S, HNO3), нелетучие (H2SO4, H3PO4).
- Степень диссоциации: сильные (HNO3, HCl) и слабые (H2CO3, HClO).
- Устойчивость: стабильные (H2SO4, H3PO4) и нестабильные (распадаются, H2SO3, H2CO3).
- Растворимость в воде: нерастворимые (H2SiO3 и H3BO3) и растворимые — все остальные.
- Агрегатное состояние, в котором могут быть: газообразные (H2S, HCl), жидкие (H2SO4, HNO3) и твердые (H3PO4, H3BO3,H2SiO3).
Органические кислоты: наиболее широко распространены карбоновые кислоты — соединения, в состав которых входит карбоксильная группа -COOH. Общая формула: R-COOH, где R — углеводородный радикал. Они играют важную роль в биохимии живых организмов, участвуют в процессах обмена веществ.
1. Карбоновые кислоты классифицируют по следующим признакам:
- число карбоксильных групп:
- одноосновные: муравьиная H-COOH и уксусная CH3-COOH;
- двухосновные: щавелевая HOOC-COOH, малоновая; HOOC-CH2-COOH
- многоосновные: лимонная кислота (HOOC-CH2)2-C(OH)-COOH.
- тип углеводородного радикала:
- предельные: CH3CH2CH2COOH масляная кислота;
- непредельные: CH2=CH-CH2COOH акриловая кислота;
- ароматические: C6H5COOH бензойная кислота;
- алициклические: C4H6O2 циклопропанкарбоновая кислота;
- гетероциклические: C6H5NO2 никотиновая кислота:
- замещенные карбоновые кислоты, в состав которых входит карбоксильная группа -COOH, углеводородный радикал R и различные функциональные группы. Некоторые из них:
- галогены → галогенкарбоновые кислоты, Hal-R-COOH (хлоруксусная кислота СlСН2СООН, трифторуксусная кислота CF3COOH);
- -OH → гидроксикислоты, OH-R-COOH (гликолиевая кислота HOCH2COOH, молочная кислота СH3CH(OH)COOH);
- -NH2 → аминокислоты, H2N-R-COOH (аминоуксусная кислотаCH2NH2-COOH глицин; 1,2- амино-3-метилпентановая кислота HO2CCH(NH2)CH(CH3)CH2CH3 изолейцин). Аминокислоты — главная составная часть белков.
2. Серосодержащие органические кислоты (сульфокислоты) содержат сульфогруппы и имеют общие формулы кислот: RSO3H → сульфоновые; RSO2H → сульфиновые; RSOH → сульфеновые. Наиболее известны: 2-аминоэтансульфоновая кислота C2H7NO3S таурин и 2-амино-3-меркаптопропановая кислота HO2CCH(NH2)CH2SH цистеин.
3. Нуклеиновые кислоты — высокомолекулярные соединения, состоящие из нуклеотидов. Играют важную роль в биологии: находятся в клетках всех организмов, являются носителями генов, участвуют в передаче и реализации наследственной информации через синтез белка. Типы нуклеиновых кислот в зависимости от моносахарида-основы:
- дезоксирибонуклеиновая кислота (ДНК) — дезоксирибоза (C5H10O4);
- рибонуклеиновая кислота (РНК) — рибоза (C5H10O5).
Химические свойства
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильно полярную связь между атомами водорода и кислорода. Эти свойства вам хорошо известны. Рассмотрим их еще раз на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка. Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды.
Равновесие диссоциации карбоновых кислот смещено влево, подавляющее большинство их — слабые электролиты. Тем не менее кислый вкус, например, муравьиной и уксусной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т. е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода. Так, железо восстанавливает водород из уксусной кислоты:2СН3—СООН + Fe —> (CHgCOO)2Fe + Н2
3. Взаимодействие с основными оксидами с образованием соли и воды:2R—СООН + СаО —> (R—СОО)2Са + Н20
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):R—СООН + NaOH —> R—COONa + Н20 3R—СООН + Са(ОН)2 —> (R—СОО)2Са + 2Н20
5. Взаимодействие с солями более слабых кислот, с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия.
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — уже известная вам реакция эте-рификации (одна из наиболее важных реакций, характерных для карбоновых кислот). Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотни-мающих средств и удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт. Очевидно, что реагировать с карбоновыми кислотами, т. е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин: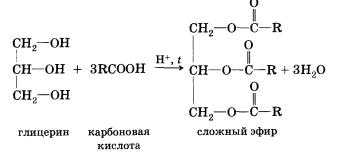
Dсе карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты; например, реакция присоединения водорода — гидрирование. При гидрировании олеиновой кислоты образуется предельная стеариновая кислота.
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду.
8. Реакции замещения (с галогенами) — в нее способны вступать предельные карбоновые кислоты; например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
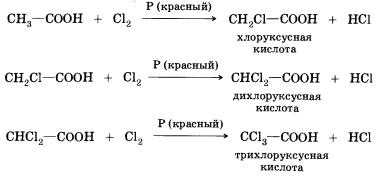
При галогенировании карбоновых кислот, содержащих более одного атома углерода в углеводородном остатке, возможно образование продуктов с различным положением галогена в молекуле. При протекании реакции по свободнорадикальному механизму могут замещаться любые атомы водорода в углеводородном остатке. Если же реакцию проводить в присутствии небольших количеств красного фосфора, то она идет селективно — водород замещается лишь в а-положении (у ближайшего к функциональной группе атома углерода) в молекуле кислоты. Причины такой селективности вы узнаете при изучении химии в высшем учебном заведении.
Карбоновые кислоты образуют различные функциональные производные при замещении гидроксильной группы. При гидролизе этих производных из них вновь образуется карбоновая кислота.
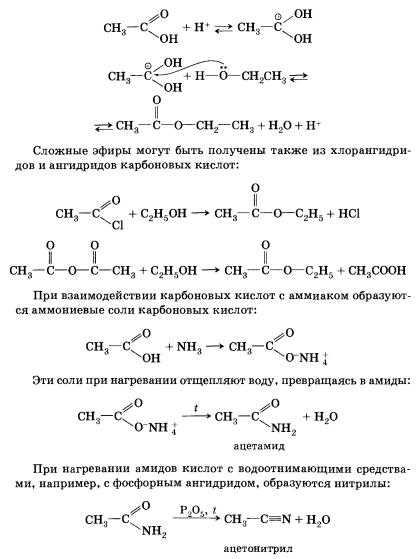
Хлорангидрид карбоновой кислоты можно получить действием на кислоту хлорида фосфора(ІІІ) или тионилхлорида (SОСl2). Ангидриды карбоновых кислот получают взаимодействием хлор-ангидридов с солями карбоновых кислот. Сложные эфиры образуются в результате этерификации карбоновых кислот спиртами. Этерификация катализируется неорганическими кислотами.
Эту реакцию инициирует протонирование карбоксильной группы — взаимодействие катиона водорода (протона) с неподеленной электронной парой атома кислорода. Протонирование карбоксильной группы влечет за собой увеличение положительного заряда на атоме углерода в ней:
Определение и формулы
Кислота – соединение, молекулы которого способны к обмену или замещению водородного катиона (протона) катионом металла с присоединением его к кислотному остатку. В химических реакциях кислотный остаток, состоящий из одного (простой) или нескольких (сложный) атомов, сохраняет свой состав.

Химические формулы
В неорганической химии общая формула кислот имеет вид где H – водород, n – количество атомов, A – кислотный остаток.
Значение n соответствует валентности кислотного остатка. Формула кислоты позволяет установить состав соединений, образуемых с ее участием, и составить уравнение реакции.
Органические карбоновые кислоты имеют общую формулу RCOOH, где R – углеводородный радикал, COOH – карбоксильная группа, атом водорода в составе которой может замещаться.
Ионные формулы
При растворении в воде происходит диссоциация – разложение – молекул кислоты на катионы H+ и анионы кислотных остатков. Поэтому кислоту можно представить в ионной записи . Так, – ионный состав соляной кислоты – серной кислоты H2SO4; – ортофосфорной кислоты H3PO4.
Диссоциация молекул карбоновых кислот происходит по схеме . Например, ионная формула пропионовой кислоты CH3CH2COOH имеет вид .
Структурные формулы
Взаимное расположение атомов и кратность связей в молекуле отражают графические, или структурные, формулы:
| Кислота | Структурная формула | Трехмерная модель молекулы |
| плавиковая HF | ||
| угольная H2CO3 | ||
| уксусная CH3COOH |
Одноосновные кислоты
Одноосновные кислоты (также называемые монопротическими кислотами) — это кислоты, молекула которых содержит одну кислородную группу и одну карбоксильную группу COOH. Эти кислоты обладают способностью отдавать водородные ионы (H+) в растворе и являются одним из наиболее распространенных классов органических кислот.
Одноосновные кислоты могут быть как органическими, так и неорганическими соединениями. Органические одноосновные кислоты обычно получают путем окисления соответствующих спиртов или альдегидов.
Примеры органических одноосновных кислот:
- Уксусная кислота (CH3COOH) — образуется при окислении этилового спирта;
- Масляная кислота (C17H34COOH) — образуется при окислении оливкового масла;
- Бензойная кислота (C6H5COOH) — образуется при окислении толуола;
- Салициловая кислота (C6H4(OH)COOH) — образуется при окислении салицилового альдегида.
Неорганические одноосновные кислоты также имеют широкое распространение. Например:
- Серная кислота (H2SO4) — одно из наиболее известных и распространенных неорганических одноосновных кислот;
- Азотная кислота (HNO3) — образуется при окислении аммиака;
- Хлороводородная кислота (HCl) — является одноосновной кислотой молекулярного галогена.
Одноосновные кислоты широко используются как катализаторы, в производстве лекарственных препаратов, в пищевой промышленности и в других отраслях.