Что такое количество вещества и как его определяют
При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Когда теплота реакции записывается так, как это сделано в данном уравнении, подразумевается, что она выражена в килоджоулях на стехиометрическую единицу («моль») реакции по записанному уравнению. Теплоты реакций всегда табулируются в расчете на моль образующегося соединения.
Для того чтобы понять, что такое количество вещества в химии, дадим термину определение. Чтобы понять, что такое количество вещества, отметим, что у данной величины есть свое обозначение. Восьмиклассники, которые еще не умеют писать химические уравнения, не знают, что такое количество вещества, как использовать данную величину в расчетах. После знакомства с законом постоянства массы веществ, становится понятно значение этой величины. Под ней подразумевают ту массу, которая соответствует одному молю конкретного химического вещества. Ни одна задача школьного курса химии, связанная с вычислениями по уравнению, не обходится без использования такого термина, как «количество вещества».

Количественные расчёты в химии
Количественные расчеты в химии ведут по формулам веществ (чтобы найти количественный состав сложного вещества, массовые доли элементов в нём) и уравнениям реакций (чтобы определить мольные, массовые и объёмные отношения между реагентами и продуктами). Такие расчеты называют стехиометрическими.
Относительная атомная масса
Атомы элементов характеризуются определённой (только им присущей) массой. Например, масса
атома Н равна 1,67 · 10−23 г,
атома С − 1,995 · 10−23 г,
атома О − 2,66 · 10−23 г.
Пользоваться такими малыми значениями неудобно, поэтому введено понятие об относительной атомной массе Аr — отношении массы атома данного элемента к атомной единице массы (1,6605 · 10−24 г).
Значения Аr элементов обычно бывают приведены в Периодической системе или собраны в отдельной таблице.
Относительная молекулярная масса. Количество вещества. Число Авогадро
Значения относительной молекулярной массы рассчитываются из значений относительной атомной массы с учётом числа атомов каждого элемента в формульной единице сложного вещества. Атомы и молекулы — частицы чрезвычайно малые, поэтому порции веществ, которые берутся для химических реакций, характеризуются физическими величинами, соответствующими большому числу частиц.
Установлено, что
12 г углерода (в виде графита или алмаза) содержат 6,02 · 1023 атомов С (Аr = 12),
28 г азота N2 содержат то же число молекул N2 (Mr = 28),
18 г H2O — то же число молекул H2O (Mr = 18) и т.д.
Количество вещества В (углерод C, азот N2, вода H2O), содержащее 6,02 · 1023 частиц и обозначаемое nВ, составляет 1 моль.
Количество вещества — это физическая величина, прямо пропорциональная числу частиц, составляющих данное вещество и входящих во взятую порцию этого вещества.
Единица количества вещества — моль — отвечает такому количеству вещества, которое содержит 6,02 · 1023 частиц этого вещества (число Авогадро). Если числу Авогадро приписать единицу измерения моль−1, то получится физическая константа — постоянная Авогадро (обозначение NА):NА = 6,02 · 1023 моль−1
Молярная масса
Количество вещества 1 моль, то есть порция, обязательно содержащая 6,02 . 1023 частиц, обладает определенной массой, характерной для данного вещества — молярной массой (обозначение М).
Молярную массу вещества В можно определить как отношение массы данной порции вещества mВ к количеству вещества nВ в этой порции:МВ = mB/nB
Единица измерения молярной массы: г/моль.
Массовая доля элемента в сложном веществе
По известной химической формуле сложного вещества определяют массовые доли элементов, входящих в это вещество. Массовая доля элемента (wЭ) в общей массе сложного вещества — это отношение массы, приходящейся на этот элемент (то есть массы части), к массе всего вещества (то есть к массе целого):wЭ = mЭ/mвещ
Массовая доля элемента — это доля от единицы или от 100%. В сложном веществе wЭ всегда меньше единицы (или меньше 100%).
Например, для воды H2O
wH = 0,11 (11%) и
wO = 0,89 (89%).
Сумма массовых долей элементов, входящих в сложное вещество, равна 1 (100%).
Закон Авогадро. Молярный объем газа. Относительная плотность газа
В химических расчетах массу газообразных реагентов и продуктов часто заменяют их объёмами.
Основной газовый закон — закон Авогадро (был высказан как гипотеза в 1811 г. итальянским физикохимиком А. Авогадро и интерпретирован с точки зрения атомно-молекулярного учения в 1858 г. итальянским химиком С. Канниццаро):
| В равных объёмах различных газов при одинаковых условиях содержится одно и то же число молекул. |
|---|
Первое следствие из закона Авогадро:При одинаковых условиях равные количества различных газов занимают равные объёмы.
В частности, при нормальных условиях (н. у.) — температуре Т = 273,15 K (0 °С) и давлении р = 1,01325 · 105 Па (1 атм, 760 мм. рт. ст.) — 1 моль любого газа (близкого по свойствам к идеальному газу), занимает объём 22,4 л.
Эта физическая постоянная — молярный объём газа при нормальных условиях.
Молярный объём газа VM равен отношению объёма порции газа В (VB) к количеству вещества в этой порции (nB):
VM = VB / nB
Единица измерения молярного объёма газа: л/моль. При нормальных условиях VM = 22,4 л/моль.
Из определения для VM следует, что VB = VMnB = (VBmB) / MB
Это выражение позволяет рассчитывать по массе газа его объем.
Второе следствие из закона Авогадро:
Молярная масса вещества в газообразном состоянии равна его удвоенной относительной плотности по водороду: MB = M(H2) · D(H2) = 2D(H2)
Аналогичным образом, с учетом средней молярной массы воздуха Mвозд = 29 г/моль:MB = Mвозд · Dвозд = 29Dвозд
Относительная плотность по водороду D(H2), по воздуху Dвозд и по любому другому газу определяется экспериментально, что позволяет рассчитать молекулярную массу газа.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Что такое n в химии и зачем он нужен
Важность символа «n» в химии связана с необходимостью указать количество частиц для правильного формирования химических формул и уравнений. Он помогает определить соотношение между различными веществами в химической реакции и установить правильные пропорции для полного использования всех реагентов
Чтобы лучше понять значение «n» в химии, давайте рассмотрим пример. Предположим у нас есть уравнение реакции:
| CnH2n+2 + O2 → CO2 + H2O |
В этом уравнении «n» обозначает количество атомов углерода и водорода в молекуле углеводорода. Значение «n» может быть любым целым числом и зависит от типа углеводорода. Например, если у нас есть метан (CH4), «n» будет равно 1. Если у нас есть этилен (C2H6), «n» будет равно 2.
Использование «n» в химии помогает нам понять, сколько атомов или молекул каждого вещества участвует в реакции. Это позволяет нам определить количество реагентов, необходимых для получения желаемого продукта, и провести расчеты эффективности реакции и ее стехиометрии.
Таким образом, использование «n» в химии является важным инструментом для понимания и описания химических реакций и формул. Он позволяет установить правильные коэффициенты в уравнениях реакций, а также проводить расчеты, необходимые для изучения и прогнозирования различных химических процессов.
Как вычислить значение «n» в химическом уравнении
Значение «n» в химическом уравнении обычно означает количество молекул, атомов или ионов, участвующих в реакции. Для вычисления значения «n» необходимо знать коэффициенты стехиометрической формулы химической реакции.
Шаги для вычисления значения «n» в химическом уравнении:
- Запишите химическое уравнение.
- Выявите вещества, для которых неизвестно значение «n».
- Найдите коэффициенты стехиометрической формулы каждого вещества.
- Установите соотношение между известными и неизвестными коэффициентами.
- Решите уравнение для неизвестного коэффициента и найдите значение «n».
Пример:
Рассмотрим химическую реакцию:
2 H2 + O2 → 2 H2O
Данное уравнение описывает реакцию сжигания водорода в присутствии кислорода, при которой образуется вода.
Для вычисления значения «n» мы знаем коэффициенты для водорода (2) и кислорода (1), а не знаем значение «n» для воды.
Используя шаги, описанные выше:
- Химическое уравнение: 2 H2 + O2 → 2 H2O
- Неизвестное значение «n» для воды H2O.
- Коэффициенты: 2 для водорода H2, 1 для кислорода O2.
- Соотношение: 2 H2 + O2 → 2 H2O.
- Решение: «n» для воды H2O равно 2.
Таким образом, значение «n» в данной реакции равно 2.
Закон сохранения массы веществ
Проблемный вопрос: изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
Чтобы ответить на данный вопрос, понаблюдайте за следующим экспериментом:
Нагревание меди в закрытом сосуде
Описание эксперимента:
В коническую колбу поместите 2 грамма измельченной меди. Плотно закройте колбу пробкой и взвесьте. Запомните массу колбы
Осторожно нагревайте колбу в течение 5 минут и наблюдайте за происходящими изменениями. Прекратите нагревание, и, когда колба охладится, взвесьте её
Сравните массу колбы до нагревания с массой колбы после нагревания.Вывод: Масса колбы после нагревания не изменилась.
Понаблюдаем за другими видео-экспериментами:
Вывод: Масса веществ до и после реакции не изменилась.
-
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.
Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки.
Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым.
Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.
Химические уравнения
Закон сохранения массы веществ применяется при составлении уравнений химических реакций.

Посмотрим видео — эксперимент:
-
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
• Исходные вещества, принимающие участие в химических реакциях, называются реагентами.
• Новые вещества, образующиеся в результате химической реакции, называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
P + O2
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O2 P2O5
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
В данном случае это атомы кислорода.
Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов кислорода –10:
Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:
P + 5O2 2P2O5
Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:
Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен:
4P + 5O2 2P2O5
2.10.5. Установление формулы химического соединения по его элементному составу
Получаем истинную формулу вещества: С2Н4- этилен. 2,5 моль атомов водорода.
Обозначается как Mr. Находится по таблице Менделеева — это просто сумма атомных масс вещества. Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ. Т. е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества. Основные формулы для решения задач по химии Это формулы.
Где в Периодической системе находятся элементы, соответствующие простым веществам металлам? Из приведенных ниже предложений выпишете номера соответствующие металлам в один столбик, а номера соответствующие неметаллам в другой столбик. Для получения определенного количества продукта(в химической лаборатории или на заводе) необходимо брать строго определенные количества исходных веществ. Химики, проводя эксперименты, заметили, что состав продуктов некоторых реакций зависит от того, в каких соотношениях были взяты реагирующие вещества. Сколько в этой массе будет атомов?
N – число структурных звеньев, а NA — постоянная Авогадро. Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным. V – объем газа (л), а Vm – молярный объем (л/моль).
Единица измерения количества вещества в Международной системе единиц (СИ) — моль.Определение. Запишите формулу для расчета этой энергии и названия физических величин,входящих в формулу. Данный вопрос относится к разделу «10-11″ классов.

Поговорим о том, что такое количество вещества, как данный термин используется в предметах естественнонаучного цикла
Так как количественным отношениям в химии, физике отводится серьезное внимание, важно знать физический смысл всех величин, их единицы измерения, области применения
Обозначение, определение, единицы измерения
В химии особое значение имеют количественные отношения. Для проведения расчетов по уравнениям используются специальные величины. Для того чтобы понять, что такое количество вещества в химии, дадим термину определение. Это физическая величина, которая характеризует число аналогичных структурных единиц (атомов, ионов, молекул, электронов), имеющихся в веществе. Чтобы понять, что такое количество вещества, отметим, что у данной величины есть свое обозначение. При проведении расчетов, подразумевающих применение этой величины, используют букву n. Единицы измерения – моль, кмоль, ммоль.
Значение величины
Восьмиклассники, которые еще не умеют писать химические уравнения, не знают, что такое количество вещества, как использовать данную величину в расчетах. После знакомства с законом постоянства массы веществ, становится понятно значение этой величины. К примеру, в реакции горения водорода в кислороде соотношение реагирующих веществ составляет два к одному. Если будет известна масса водорода, вступившего в процесс, можно определить количество кислорода, принявшего участие в химической реакции.
Применение формул на количество вещества позволяет сократить соотношение между исходными реактивами, упростить вычисления. Что такое количество вещества в химии? С точки зрения математических вычислений, это стереохимические коэффициенты, поставленные в уравнении. Именно их используют для того, чтобы проводить определенные вычисления. Та как считать количество молекул неудобно, то пользуются именно Молем. Используя число Авогадро, можно рассчитать, что 1 моль любого реагента включает 6 ·1023 моль−1.

Вычисления
Хотите понять, что такое количество вещества? В физике также используется данная величина. Она нужна в молекулярной физике, где проводятся вычисления давления, объема газообразных веществ по уравнению Менделеева-Клапейрона. Чтобы выполнять любые количественные расчёты, применяется понятие молярной массы.
Под ней подразумевают ту массу, которая соответствует одному молю конкретного химического вещества. Определить молярную массу можно через относительные атомные массы (их сумму с учетом числа атомов в молекуле) или определить через известную массу вещества, его количество (моль).
Ни одна задача школьного курса химии, связанная с вычислениями по уравнению, не обходится без использования такого термина, как «количество вещества». Владея алгоритмом, можно справиться не только с обычными программными расчётами, но и со сложными олимпиадными заданиями. Помимо вычислений через массу вещества, также можно с помощью данного понятия, проводить вычисления через молярный объем. Это актуально в тех случаях, когда во взаимодействии принимают участие газообразные вещества.
Пример использования n в химическом расчете
Допустим, нам известно, что происходит реакция между двумя веществами A и B:
A + B → C
Мы хотим узнать, сколько граммов продукта C будет образовано при реакции, если у нас имеется определенное количество веществ A и B, представленное в молях.
Для расчета массы продукта C нам понадобится знать соотношение между количеством вещества и их молярной массой:
масса = количество вещества × молярная масса
Пусть у нас есть nA моль вещества A и nB моль вещества B. По условию задачи, известно, что каждая молекула реагента A реагирует с каждой молекулой реагента B, образуя единичное количество продукта C.
Тогда, если nA и nB – это количество вещества в молях, то масса продукта C будет равна:
масса C = nA × молярная масса C
или
масса C = nB × молярная масса C
После решения этого уравнения мы можем получить массу продукта C в граммах.
Таким образом, использование n в химическом расчете может помочь нам определить количество продукта, образующегося в результате химической реакции, и выполнить расчеты массы вещества.
Определение эквивалентного количества вещества по вторичному облаку
Определение эквивалентного количества вещества по первичному облаку
Определение количественных характеристик выброса
Прогнозирование глубин зон заражения СДЯВ
Исходные данные для прогнозирования масштабов заражения СДЯВ
1. Общее количество СДЯВ на объекте и данные по размещению их запасов в емкостях и технологических трубопроводах.
2. Количество СДЯВ, выброшенных в атмосферу, и характер их разлива на подстилающей поверхности («свободно», «в поддон» или «обваловку»).
3. Высота поддона или обваловки складских емкостей.
4. Метеорологические условия: температура воздуха, скорость ветра (на высоте флюгера), степень вертикальной устойчивости воздуха.
При заблаговременном прогнозировании масштабов заражения на случай производственных аварий в качестве исходных данных рекомендуется принимать: за величину выброса СДЯВ (Q о
) – его содержание в максимальной по объему емкости (технологической, складской, транспортной и др.), метеорологические условия – степень вертикальной устойчивости воздуха, скорость ветра и температуру. Для прогноза масштабов заражения непосредственно после аварии должны браться конкретные данные о количестве выброшенного (разлившегося) СДЯВ, время, прошедшее после аварии, и характер разлива на подстилающей поверхности. Внешние границы зоны заражения СДЯВ рассчитываются по пороговой токсодозе при ингаляционном воздействии на организм человека.
Расчет глубины зоны заражения СДЯВ ведется с помощью данных, приведенных в таблицах 11-13, значение глубины зоны заражения при аварийном выбросе (разливе) СДЯВ определяется по таблице 8 в зависимости от количественных характеристик выброса и скорости ветра.
Количественные характеристики выброса СДЯВ для расчета масштабов заражения определяются по их эквивалентным значениям.
Для сжатых газов эквивалентное количество вещества определяется только по первичному облаку.
Для сжиженных СДЯВ, температура кипения которых выше температуры окружающей среды, эквивалентное количество вещества определяется только по вторичному облаку. Для СДЯВ, температура кипения которых ниже температуры окружающей среды, эквивалентное количество вещества определяется по первичному и вторичному облаку.
Эквивалентное количество вещества по первичному облаку (в тоннах) определяется по формуле
где К 1
— коэффициент, зависящий от условий хранения СДЯВ, таблица 12;
К 3
— коэффициент, равный отношению пороговой токсодозы хлора к пороговой токсодозе другого СДЯВ, таблица 12;
К 5
— коэффициент, учитывающий степень вертикальной устойчивости воздуха (принимается равным для инверсии – 1; для изотермии – 0,23; для конвекции – 0,08), таблица 11;
К 7
— коэффициент, учитывающий влияние температуры воздуха, таблица 12;
Q o
— количество выброшенного (разлившегося) при аварии вещества, т.
Эквивалентное количество вещества по вторичному облаку рассчитывается по формуле
где К 2
– коэффициент, зависящий от физико-химических свойств СДЯВ, таблица 12;
К 4
– коэффициент, учитывающий скорость ветра, таблица 13;
К 6
– коэффициент, зависящий от времени, прошедшего после начала аварии; N
, К 6
определяется после расчета продолжительности t
И времени испарения вещества, при N = t И;
h
– толщина слоя СДЯВ, м;
d
– плотность СДЯВ, т/м3, таблица 12.
Высота разлившейся жидкости при свободном разливе принимается 0,05 м. Если имеется поддон или емкость обвалована, то
где Н – высота поддона или обваловки.
Время испарения СДЯВ рассчитывается по формуле
, (ч). (4)
Таблица 11
Определение степени вертикальной устойчивости воздуха по прогнозу погоды
ПРИМЕЧАНИЕ:
1. Обозначение: ин –
инверсия; из
– изотермия; к
– конвекция, буквы в скобках — при снежном покрове.
2. Под термином «утро»
понимается период времени в течение двух часов после восхода солнца; под термином «вечер»
— в течение двух часов после захода солнца.
Период от восхода до захода за вычетом двух утренних часов – день,
а период от захода до восхода за вычетом двух вечерних часов – ночь.
3. Скорость ветра и степень вертикальной устойчивости воздуха принимается в расчетах на момент аварий.
Таблица 9
Таблица 13
Значение коэффициента К 4 в зависимости от скорости ветра
| Скорость ветра, м/с | |||||||||||
| К 4 | 1,0 | 1,33 | 1,67 | 2,0 | 2,34 | 2,67 | 3,0 | 3,34 | 3,67 | 4,0 | 5,68 |
Значение n в других областях химии
Понятие «n» не ограничивается только задачами и уравнениями в химии, оно также имеет значение в других областях химической науки. Например, в органической химии «n» может обозначать число повторяющихся единиц в полимерной цепи
Это особенно важно при изучении полимеров, таких как полиэтилен, полипропилен и поливинилхлорид, где «n» указывает на количество мономерных единиц в молекуле полимера
Кроме того, в аналитической химии «n» может указывать на количество эквивалентных точек перехода в титровании. Например, при титровании кислоты с щелочью «n» будет равно числу молей кислоты, которые реагируют с одной молью щелочи.
В физической химии «n» может относиться к степени полимеризации или степени диссоциации в растворе. Например, при изучении полимеров «n» будет указывать на среднюю длину полимерной цепи в отношении единиц повторения, а в растворах «n» будет означать количество ионов, на которые диссоциирует одна молекула растворенного вещества.
В общем, значение «n» в химии может различаться в зависимости от конкретной области исследования. Это позволяет ученым более точно определить и описать химические процессы и свойства различных веществ.
Что значит » n » в химии 8 класс?
ГенетическаяПомогите химию 8 класс Генетическая связь между классами неорганических веществ. 1. Осуществите превращения: Cu -> CuO -> CuSO4 -> Zn(OH)2-> CuCl2 2. Даны вещества: Ca(OH)2, HNO3, HgO, Hg, AgNO3. C какими из них вступает в реакцию оксид углерода(lV) ? помогите пожалуйста.
Надо решить одну из задач: 1)на этикетке бутылки пищевого уксуса написано «уксус. концентрация 9%» поясните что это значит: раствор какого вещества в каком? каковы их массовые соотношения?
2) определите массы воды и соли которые потребуются для приготовления 250 г раствора с массовой долей солей =12 %
3) в 1 л воды растворили 250г сахара. Определите массовую долю (%) сахара в подученном растворе
P.S. Спасибо за помощь!
1.Составьте план получения раствора алюмината натрия из алюминия двумя способами.Реализуйте короткий путь получения этого вещества.2.Из хлорида цинка получите гидроксид цинка и докажите,что он обладает амфотерными свойствами.Какие вещества вам для этого понадобятся?3.Какие превращения необходимо последовательно провести,чтобы получить сульфат меди(II)?Какие вещества для этого понадобятся?Составьте план эксперимента и осуществите его.4.Составьте план получения гидроксида железа(II) из железа и доказательства того,что он проявляет основные свойства.Какие вещества вам потребуются для выполнения эксперимента?Проведите эксперимент согласно намеченному плану.Я так думаю,что можно просто составить уравнения реакций.Помогите.
Моль — единица химического количества вещества
Каждая из основных физических величин имеет свою единицу. Например, единица длины — метр (м), массы — килограмм (кг), времени — секунда (с). Единицей химического количества вещества является моль.
Моль — порция вещества (т. е. такое его химическое количество), которая содержит столько же структурных единиц, сколько атомов содержится в углероде массой 0,012 кг.
Сокращенное обозначение единицы химического количества записывается, как и полное, — моль. Поэтому, если слово «моль» стоит после числа, то оно не склоняется, так же, как и другие сокращенные единицы величин: 3 кг, 5 л, 8 моль. При чтении вслух и при записи числительного буквами слово «моль» склоняется: три килограмма, пять литров, восемь молей.
На заметку. Термины «молекула» и «моль», как нетрудно заметить, однокоренные. Они действительно произошли от одного и того же латинского слова «moles». Но это слово имеет, по крайней мере, два значения. Первое — «маленькая масса». Именно в этом смысле в XVII в. оно превратилось в термин «молекула». А понятие «моль» (в смысле кучка, порция) появилось значительно позже, в начале ХХ в. Автор этого термина известный немецкий химик и физик Оствальд толковал его смысл как «большая масса», как бы противопоставляя термину «молекула».
Число (N) атомов в порции углерода массой 0,012 кг легко определить, зная массу одного атома углерода (19,94·10-27 кг):
Следовательно, в углероде массой 0,012 кг содержатся 6,02·1023 атомов углерода и эта порция составляет 1 моль. Столько же структурных единиц содержится в 1 моль любого вещества.
Величина, равная:
получила название постоянной Авогадро. Она является одной из важнейших универсальных постоянных и обозначается символом NA:
Единица в числителе дроби (1/моль) заменяет название структурной единицы.
Если структурной единицей вещества (например, меди, углерода) является атом, то в порции этого вещества количеством 1 моль содержатся 6,02·1023атомов. В случае веществ молекулярного строения (вода, углекислый газ) их порции количеством 1 моль содержат по 6,02·1023молекул. Если структурными единицами веществ немолекулярного строения (например, NaCl или CuSO4) являются их формульные единицы, то в порциях этих веществ количеством 1 моль содержатся по 6,02·1023формульных единиц.
На заметку. Численное значение постоянной Авогадро огромно. О том, насколько велико это число, можно судить по следующему сравнению. Поверхность Земли, включая и водную, равна 510 000 000 км2. Если равномерно рассыпать по всей этой поверхности 6,02·1023 песчинок диаметром 1 мм, то они образуют слой песка толщиной более 1 м.
Зная химическое количество n данного вещества Х, легко рассчитать число молекул (атомов, формульных единиц) N(Х) в этой порции:
если 1 моль вещества содержит 6,02·1023 молекул, то n моль вещества содержат N(Х) молекул.
Отсюда:
И наоборот, по числу структурных единиц можно рассчитать химическое количество вещества:
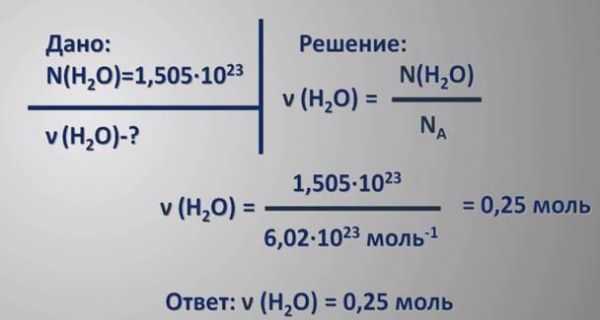
Пример 1. Определите число молекул, содержащихся в серной кислоте химическим количеством 3 моль.
Спойлер
Пример 2. Рассчитайте химическое количество CuSO4 в порции, содержащей 36,12·1023 формульных единиц (ФЕ).
Спойлер
Краткие выводы урока:
- Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
- Моль — единица химического количества вещества, т. е. такое его количество, которое содержит 6,02·1023 структурных единиц.
Надеюсь урок 8 «Химическое количество вещества и моль» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Важность понимания «n» в химии
Правильное понимание значения «n» позволяет установить соотношение между различными веществами, определить их состав, молекулярные пропорции и стехиометрию реакций. Знание «n» помогает ученым и химикам прогнозировать результаты реакций, а также создавать новые соединения и материалы.
Например, в химической формуле H2O, «n» равно 2, что указывает на то, что водный молекул состоит из двух атомов водорода и одного атома кислорода. Благодаря пониманию «n» мы можем определить правильное соотношение компонентов в реакции и предсказать, сколько вещества будет образовано или потребуется для проведения реакции.
Понимание значения «n» также важно при изучении реакций с участием ионов. Например, в химической формуле NaCl, «n» равно 1, что означает, что каждый ион натрия соответствует одному иону хлорида
Это знание позволяет понять, какие вещества будут образовываться и какие свойства будут иметь реакционная смесь.