Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
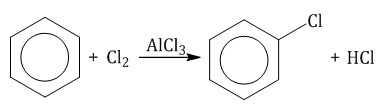
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
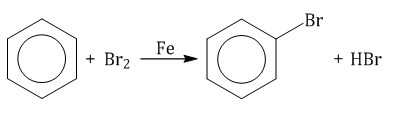
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
|
Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
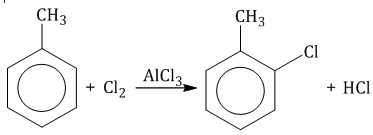
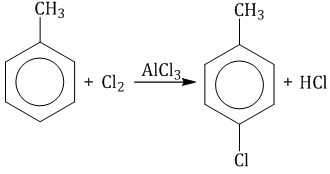
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
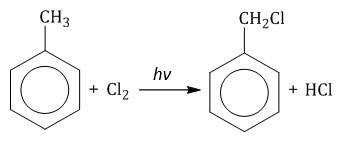
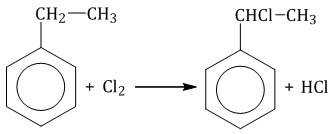
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
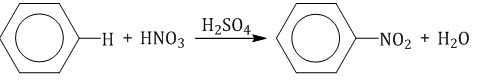
| Серная кислота способствует образованию электрофила NO2+: |
![]()
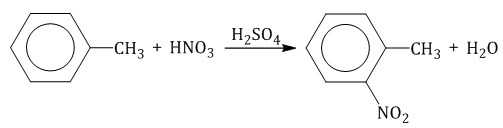
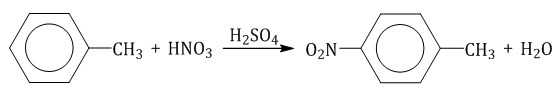
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
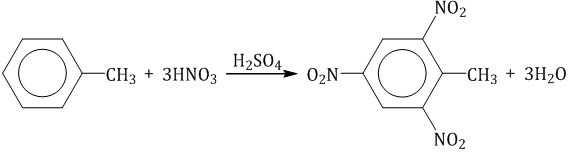
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
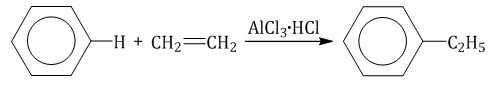
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
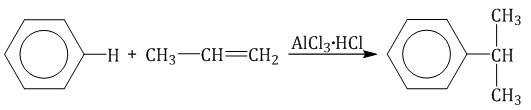
Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
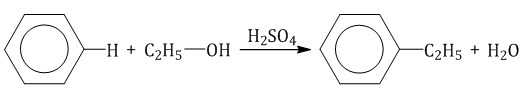
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
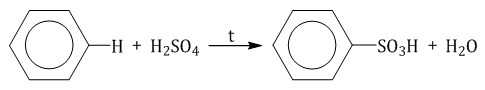
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Получение карбоновых кислот
Некоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот
Общие способы получения карбоновых кислот
1. Окисление первичных спиртов и альдегидов под действием различных окислителей
Окисление спиртов
В качестве окислителей применяют KMnO4 и K2Cr2O7.
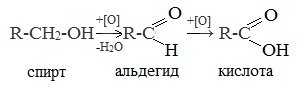
Например:
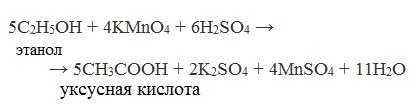
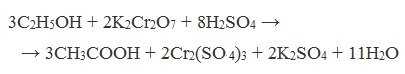
Окисление альдегидов
Для окисления альдегидов используются те же реагенты, что и для спиртов.
При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора.
При окислении дихроматом калия — цвет меняется с оранжевого на зеленый.

А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов:
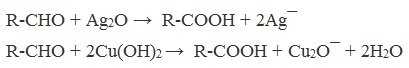
2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода
В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
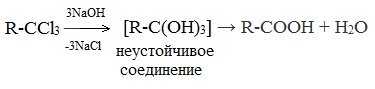
3. Получение карбоновых кислот из цианидов (нитрилов)
Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия:
![]()
Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония:
При подкислении раствора выделяется кислота:
![]()
4. Использование реактива Гриньяра (по схеме)
![]()
5. Гидролиз галогенангидридов кислот
С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:
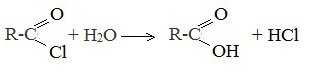
В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением)
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
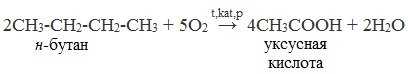
3. Окисление алкенов и алкинов
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
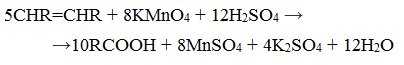
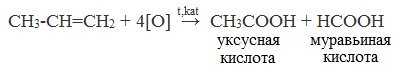
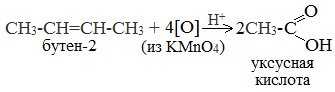
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
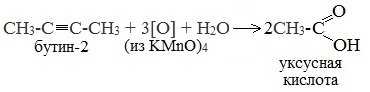
4. Окисление гомологов бензола (получение бензойной кислоты)
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
![]()
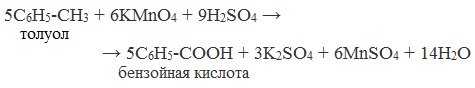
В лаборатории
1. Гидролиз сложных эфиров
При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации):
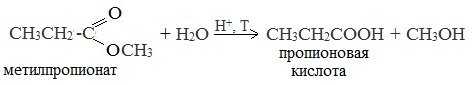
2. Из солей карбоновых кислот
![]()
3. Гидролиз ангидридов кислот
При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты:
4. Щелочной гидролиз галоген производных карбоновых кислот
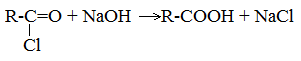
Специфические способы получения важнейших кислот
Способы получения НСООН
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой:
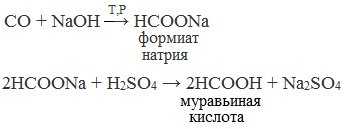
2. Каталитическое окисление метана
3. Декарбоксилирование щавелевой кислоты
Муравьиную кислоту можно получить при нагревании щавелевой кислоты:
Способы получения СН3СООН
Получение уксусной кислоты для химических целей
1. Синтез из ацетилена
Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана):
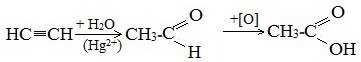
2. Каталитическое окисление бутана
Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха:
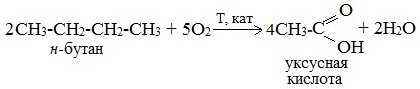
Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект.
3. Каталитическое карбонилирование метанола
Получение уксусной кислоты для пищевых целей
4. Уксуснокислое брожение этанола
Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво):
![]()
Рубрики: Карбоновые кислоты Теги: Карбоновые кислоты
Избыток и недостаток
Передозировка бензойной кислотой ухудшает работу печени, почек, легких, вызывает проблемы с психикой. У человека наблюдаются признаки астмы, аллергическая реакция (отек, высыпания), нарушается работа щитовидной железы.
Дефицит кислоты в организме вызывает расстройство пищеварительного тракта, головные боли, депрессию. У человека нарушается обмен веществ, возникает слабость, раздражительность, волосы становятся ломкими. В результате длительной нехватки «природного консерванта» наступает анемия.
Потребность организма в соединении снижается при низком уровне свертываемости крови, в состоянии покоя, при патологиях щитовидной железы и увеличивается при аллергии, загущении крови, инфекционных заболеваниях.
Интересно, что бензойная кислота (в пределах нормы) улучшает выработку молока у кормящих женщин.
Описание, физические свойства соединения
При комнатной температуре бензойная кислота выглядит как белый порошок. Если рассмотреть его под микроскопом, вы увидите, что кристаллы имеют форму игл или чешуек (табличек). Соединение обладает резким специфическим запахом. Химическая формула этой карбоновой (органической) кислоты – C6H5COOH или C7H6O2. При нагревании до 122,4 ⁰C она начинает плавиться, а при 249 ⁰C — кипеть, дальнейшее повышение температуры до 370 ⁰C приведёт к термическому разложению. Нетрудно подсчитать молярную массу соединения, она составляет 122,12 грамм/моль. Реагент очень плохо растворяется в воде, а в этаноле и эфирах — хорошо. Реактив C6H5COOH является слабой кислотой, константа её диссоциации составляет 4,202.

Строение бензола
Молекулярная формула бензола С6Н6. Очевидно, что это ненасыщенный углеводород — не хватает восьми атомов водорода до полного насыщения — С6Н14. Для ненасыщенных углеводородов характерно обесцвечивание раствора перманганата калия и бромной воды. Проверим это на опыте с бензолом.
Демонстрационный опыт. В двух пробирках находится бензол. В одну пробирку прильём бромную воду, в другую — раствор перманганата калия. Наблюдая за тем, что происходит в пробирках, мы заметим, что бензол не обесцвечивает бромную воду и раствор перманганата калия.
Проблема. Почему бензол не обесцвечивает бромную воду и раствор КМnO4? Какие можно сделать предположения о строении бензола?
Опыт позволяет предположить, что бензол не образует прямую или разветвлённую цепь, в которой находятся двойные или тройные связи. Это же самое доказывает и реакция гидрирования бензола. Экспериментально также установлено, что молекула бензола (1 моль) присоединяет только три молекулы водорода (3 моль), в результате чего получается циклическое соединение — циклогексан:
Из этого следует, что бензол — углеводород циклического строения.
Значительно позже русским учёным Н.Д. Зелинским была проведена обратная реакция — каталитическое дегидрирование циклогексана. В результате этой реакции был получен бензол:
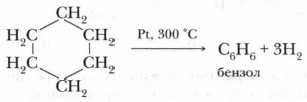
Немецкий химик Ф.А. Кекуле в 1865 г. высказал предположение о циклическом строении бензола с чередованием простых (одинарных) и двойных (кратных) связей и предложил выразить это структурной формулой следующим образом (1, 2):
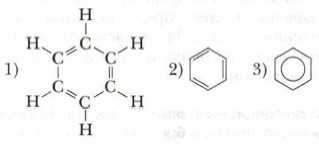
|
В современной химии наряду с традиционными формулами Кекуле часто пользуются структурной формулой бензола, в которой акцент сделан на бензольное кольцо (3). |
Более точное представление о том, как в молекуле бензола размещены химические связи, можно получить, основываясь на современных представлениях об электронном строении молекулы бензола и данных рентгено-структурного анализа.
Все атомы углерода в молекуле бензола находятся в sh2-гибридном состоянии. Каждый атом углерода образует три σ-связи: с двумя соседними атомами углерода и одним атомом водорода. Эти связи лежат в одной плоскости, и углы между ними равны 120° (рис. 30). Таким образом, шесть атомов углерода образуют правильный шестиугольник. Кроме того, каждый атом углерода имеет одну негибридную 2p-орбиталь, на которой находится один электрон.
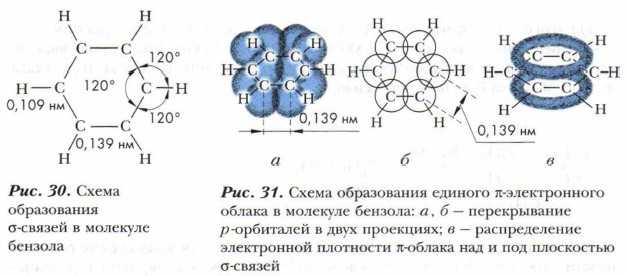
Негибридная р-электронная орбиталь каждого атома углерода перекрывается рядом находящимися негибридными р-электронными облаками слева и справа, образуется единое π-электронное облако, состоящее из шести электронов. Электронная плотность в нём распределена равномерно (рис. 31). Все связи между атомами углерода одинаковые. Перекрывание происходит над и под плоскостью σ-связей. С подобным явлением вы уже знакомились при изучении диеновых углеводородов, содержащих сопряжённые двойные связи (см. § 13).
Исследования показали, что в бензоле нет простых и двойных связей, под влиянием π-электронного облака ядра атомов углерода сближаются, и расстояние между центрами соседних атомов углерода сокращается и становится одинаковым — 0,139 нм. Вспомним, что длина одинарной связи С—С равна 0,154 нм, а двойной связи С=С — 0,134 нм.
В настоящее время используют следующие современные структурные формулы молекулы бензола:
Чаще всего пользуются формулой в виде правильного шестиугольника с окружностью в цикле.
Электронное строение бензола объясняет загадки молекул бензола:
- благодаря сопряжению электронная плотность в бензольном кольце выравнивается, расстояния между атомами углерода одинаковые;
- благодаря сопряжению молекула бензола становится более устойчивой, связь между атомами углерода в бензольном кольце значительно прочнее;
- бензол стоек к действию окислителей, реакции присоединения затруднены.
Плоскость, в которой расположены атомы углерода, называется бензольным ядром или бензольным кольцом.
Бензольное ядро — это прочная система. Связь в бензольном ядре часто называют ароматической. Делокализованная π-связь (см. рис. 31, б, в) — главный признак принадлежности веществ к группе ароматических соединений. По международной номенклатуре ароматические углеводороды называются аренами.
|
Ароматические углеводороды, или арены, — это органические соединения, в молекулах которых имеется одно или несколько бензольных колец. Общая формула углеводородов ряда бензола, имеющих одно бензольное кольцо, CnH2n-6. |
Известны также небензоидные ароматические соединения, например гетероциклические.
Задания с развернутым ответом на арены.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
CH4 X1 X2 X3 X4 X5 X6
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
CH3-CH2-CH2-Br X1 X2 X3 X4 X5
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
CaC2 ацетилен бензол кумол 2-хлор-2-фенилпропан
2-фенилпропен 1,2-дибром-2-фенилпропан
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
н-гептан толуол п-диметилбензол 2-бром-1,4-диметилбензол X
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
карбид кальция X1 X2 C3H4 X3 X4
Задание №6
При сжигании навески неизвестного углеводорода образовалось 20,16 л углекислого газа и 10,8 г паров воды. Плотность паров вещества по пропину равна 3. Определите молекулярную формулу углеводорода и его структуру, если известно, что его можно получить в результате реакции пропилена с другим веществом.
n(CO2) = V/Vm = 20,16/22,4 = 0,9 моль, следовательно, n(C) = n(CO2) = 0,9 моль,
n(H2O) = m(H2O)/M(H2O) = 10,8/18 = 0,6 моль, следовательно, n(H) = 2n(H2O) = 2⋅0,6 = 1,2 моль,
n(C):n(H) = 0,9:1,2 = 1:1,333 = 3:4, т.е. простейшая формула C3H4.
M(C3H4) = 12⋅3+4 = 40 г/моль,
M(в-ва) = M(пропин)⋅Dпропин(в-ва) = 40⋅3 = 120 г/моль,
Поскольку истинная молярная масса больше в три раза, это означает, что простейшую формулу необходимо утроить, т.е. истинная молекулярная формула вещества C9H12.
Поскольку в условии сказано, что искомое вещество может быть получено взаимодействием пропилена с другим веществом, по всей видимости, речь идет об изопропилбензоле (кумол). Структурная формула кумола:
Задание №7
При сжигании навески неизвестного углеводорода образовалось 30,8 г углекислого газа и 7,2 г паров воды. Плотность паров вещества по оксиду азота(IV) равна 2. Определите молекулярную формулу углеводорода и его структуру, если известно, что это вещество не обесцвечивает бромную воду.
n(CO2) = m(CO2)/M(CO2) = 30,8/44 = 0,7 моль, следовательно, n(CO2) = n(C) = 0,7 моль,
n(H2O) = m(H2O)/M(H2O) = 7,2/18 = 0,4 моль, следовательно, n(H) = 2n(H2O) = 2*0,4 = 0,8 моль,
n(C):n(H) = 0,7:0,8 = 1:1,143 = 7:8
Таким образом, простейшая формула искомого углеводорода C7H8.
Если предположить, что данная формула также является и истинной молекулярной формулой вещества, то таким веществом может быть толуол:
Действительно, толуол удовлетворяет условиям задачи, в частности, не обесцвечивает бромную воду.
Получение и очистка
Как уже было описано выше, впервые бензойную кислоту выделили из росного ладана. Это природное соединение представляет собой смолу стираксового дерева. Для этого измельчённое сырье прогревали на песчаной бане и собирали сублимирующиеся кристаллы в небольшом ящичке, оклеенном бумагой. Полученный продукт имел приятный аромат из-за присутствия эфирных масел в росном ладане – коричного и ванильного.

Также использовался метод взаимодействия гиппуровой кислоты с соляной при сильном нагревании. Первую получали путём упаривания мочи травоядных, затем очищали кристаллизацией до исчезновения характерного запаха. А как же протекает современный синтез такого вещества как бензойная кислота? Получение её очень дешёво, просто и экологично. Его проводят при помощи промышленного оксидирования метилбензола KMnO4, либо частичным взаимодействием исходного реагента с O2. Очистка сырья основана на физических свойствах реактива — низкой растворимости бензойной кислоты в холодной воде и высокой — в горячей, и называется перекристаллизацией.
Химические свойства бензола
1. Реакция горения
Как все углеводороды, бензол сгорает с образованием углекислого газа и воды:
2С6Н6 + 15O2 → 12СО2 + 6Н2O
Бензол горит коптящим пламенем.
Задание. Вычислите массовую долю (%) углерода в бензоле.
2. Реакции замещения
Наличие π-электронного облака в бензольном кольце, а также его пространственная доступность создают предпосылки для протекания реакций замещения. Для аренов характерны реакции электрофильного замещения в бензольном кольце. Важнейшими из таких реакций являются: галогенирование и нитрование.
А. Галогенирование
Бензол при обычных условиях не обесцвечивает бромную воду, но при нагревании в присутствии железных стружек вступает в реакцию, при этом образуется тяжёлая жидкость бромбензол — СбН5Вr:
Б. Нитрование
При действии на бензол нитрующей смеси (концентрированные серная и азотная кислоты) и при нагревании происходит реакция замещения, нитрогруппа азотной кислоты — NO2 замещает атом водорода в молекуле бензола:
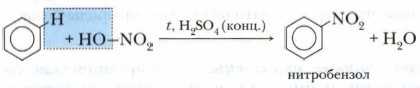
При этом образуется желтоватая тяжёлая жидкость, нерастворимая в воде, с запахом горького миндаля — нитробензол C6H5NO2 которая используется в качестве растворителя, а также для получения анилина.
3. Реакции присоединения
Проблема. Бензол с большим трудом вступает в реакции присоединения. Почему это происходит?
Реакции присоединения аренов связаны с разрушением устойчивой системы бензольного кольца. Они энергетически невыгодны и протекают только при нагревании или при облучении.
А. Галогенирование
Реакция присоединения хлора к бензолу идёт при УФ-облучении и температуре кипения бензола. При этом образуется гексахлорциклогексан:
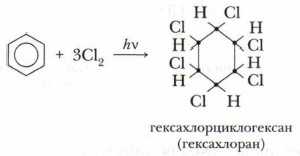
Гексахлорциклогексан — ядохимикат, который до недавнего времени использовался для защиты растений от насекомых, но он опасен для жизни человека, а потому заменён на более безопасные и легко разлагаемые пестициды.
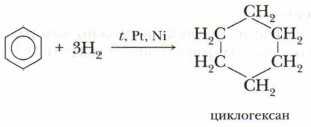
Б. Гидрирование
Эта реакция идёт в присутствии катализаторов (Pt, Ni) и при нагревании:
Применение
По внешнему виду бензойная кислота – продолговатые кристаллы белого цвета, которые имеют характерный блеск. При температуре 122 градуса по Цельсию переходит в газообразное состояние. Бензойная кислота растворима в спиртах, воде, жирах. В промышленных масштабах производится путем окисления толуола. Помимо этого, вещество получают из бензотрихлорида, фталевой кислоты.
Консервант используется в хлебопекарной, кондитерской, пивоваренной промышленностях для производства следующей продукции:
- фруктовых, овощных пюре;
- безалкогольных напитков;
- ягодных соков;
- рыбных продуктов;
- консервированных фруктов, оливок;
- мороженого;
- варенья, джема, повидла;
- овощной консервации;
- маргарина;
- жевательной резинки;
- конфет и сахарозаменителей;
- деликатесной икры;
- молочных изделий
- ликера, пива, вина.
Антисептические, антибактериальные способности бензойной кислоты используют в фармакологической промышленности для производства противогрибковых медикаментов, мазей от чесотки. А специальные ванночки для стоп с применением органического соединения избавляют от чрезмерной потливости, грибка ног. Помимо этого, бензойную кислоту добавляют в сиропы от кашля, поскольку она обладает отхаркивающим свойством и разжижает мокроту.
В качестве консервирующего вещества ее используют в косметике для сохранения полезных свойств и продления срока годности кремов, лосьонов, бальзамов. Благодаря сильным отбеливающим свойствам, соединение входит в состав масок, действие которых направлено на избавление лица от веснушек, неровностей на коже, пигментных пятен.
Номенклатура
Название кислот образуется так, что к названию предельного углеводорода прибавляется
-овая кислота.
|
Формула алкана |
Название алкана |
Формула кислоты |
Название кислоты. |
|
СН4 |
метан |
НСООН |
метановая кислота (муравьиная) |
|
С2Н6 |
этан |
СН3СООН |
этановая кислота (уксусная) |
|
С3Н8 |
пропан |
С2Н5СООН |
пропановая кислота (пропионовая) |
5,5-диметилгексановая кислота
2-этилбутановая кислота
пентан-3-карбоновая кислота
3-карбокси-3-гидроксипентандиовая-1,5 кислота (лимонная)
Тривиальные названия важнейших кислот
Алифатические предельные одноосновные кислоты:
НСООН муравьиная
СН3СООН уксусная
С2Н5СООН пропионовая
С3Н7СООН масляная
С5Н11СООН валериановая
С6Н13СООН капроновая
С15Н31СООН пальмитиновая
С17Н35СООН стеариновая
Непредельные кислоты:
СН2=СН-СООН акриловая
СН3-(СН2)7-СН=СН-(СН2)7-СООН олеиновая
Ароматические кислоты:
С6Н5COOH бензойная
Двухосновные кислоты:
НООС-СООН щавелевая
НООС-СН2-СООН малоновая
Химические свойства анилина
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
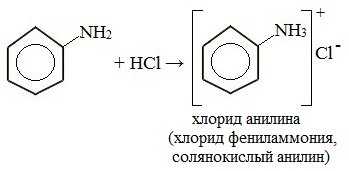
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях:
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
![]()
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
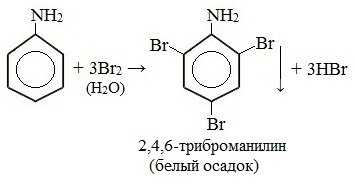
Качественная реакция на анилин!
Видеоопыт «Бромирование анилина»
2. Сульфирование
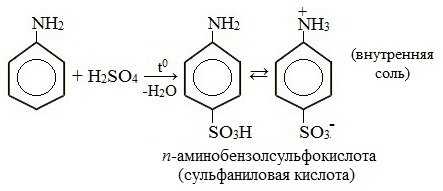
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
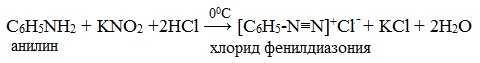
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
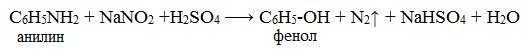
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Рубрики: Амины Теги: Амины
Химические свойства
Бензойная кислота проявляет все свойства карбоновых кислот: образование эфиров при взаимодействии со спиртами, образования амидов и тому подобное.
Бензойная кислота устойчива к действию многих окислителей: воздух, перманганат, гипохлоритов. Однако, при нагревании свыше 220 ° C она взаимодействует с солями меди (II), образуя фенол и его производные. В результате взаимодействия кислоты с аммиаком образуется анилин.
Нагрев бензойную кислоту до 370 ° C в присутствии катализатора (медный или кадмиевый порошки), происходит декарбоксилирование, что ведет к бензола на незначительных количеств фенола.
При участии катализатора оксида циркония бензойную кислота может гидруватися к бензальдегида с количественным выходом. А гидрирования в присутствии благородных металлов ведет к образованию циклогексанкарбоновои кислоты (гексагидробензойнои).
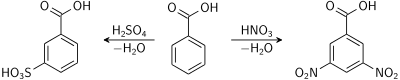
Хлорирование соединения дает продуктом преимущественно 3-хлоробензойну кислоту. Нитрования и сульфирования происходит аналогично по третьему положением.
Соли бензойной кислоты
Рассмотрим какие бывают бензоатами, их свойства и применение:
- Бензоат аммония. Представляет собой неорганическое соединение бензойной кислоты и соли аммония. Не имеет цвета, хорошо растворяется в этаноле, воде. Структурная формула – NH4(C6H5COO). Используется как антисептик (предупреждает процессы разложения на поверхности открытых ран), консервант в пищевой промышленности для увеличения срока годности продуктов, стабилизатора при изготовлении клеев, латексов и ингибитора коррозии.
- Бензоат лития. Это белая кристаллическая соль лития и бензойной кислоты. Химическая формула соединения – C6H5 – COOLi. Имеет сладковатый вкус, без запаха, растворяется в воде. Используется в фармакологии как нормотимическое средство для нормализации психического состояния. Оказывает антиманиакальное, седативное, антидепрессивное действие. Данный эффект обусловлен тем, что ионы лития вытесняют из клеток ионы натрия, снижая биоэлектрическую активность нейронов мозга. В результате падает уровень серотонина в тканях, концентрация норэпинефрина, повышается чувствительность нейронов гиппокампа к действию допамина. В терапевтических концентрациях снижает концентрацию нейронального инозита и блокирует активность инозил –1–фосфатазы.
- Бензоат натрия. Выступает пищевой добавкой, зафиксирована под кодом Е211, относится к группе консервантов. Структурная формула – C6H5COONa. Натриевая соль бензойной кислоты имеет характерный неярко выраженный запах бензальдегида, белый цвет. Консервант угнетает рост плесневых грибов, включая афлатоксинообразующие, дрожжей и снижает активность ферментов, расщепляющих крахмал, триглицериды.
Лучшие материалы месяца
- Почему нельзя самостоятельно садиться на диету
- Как сохранить свежесть овощей и фруктов: простые уловки
- Чем перебить тягу к сладкому: 7 неожиданных продуктов
- Ученые заявили, что молодость можно продлить
В натуральных продуктах бензоат натрия содержится в яблоках, горчице, изюме, клюкве, корице. Применяется для консервирования плодово-ягодных, рыбных, мясных изделий, сладких газированных напитков. Входит в состав отхаркивающих средств, косметической продукции.
Помните, бензоат натрия может нарушать область ДНК в митохондриях и вызывать нейродегенеративные заболевания, болезнь Паркинсона, цирроз печени. Поэтому применение добавки Е211, из-за небезопасности для здоровья человека, в последние годы стремительно сокращается.
Таким образом, бензойная кислота и ее соли – органические добавки, используемые в пищевой, фармакологической, авиационной промышленностях и косметологии в качестве консерванта. Для сохранения здоровья употреблять продукты, содержащие Е210 нужно в умеренном количестве. Безопасная доза составляет 5 миллиграмм вещества на килограмм веса. Иначе перенасыщение организма бензойной кислотой может вызвать аллергические реакции, поражение нервной системы.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Будем признательны, если воспользуетесь кнопочками: