Содержание
- 1 Ключевые понятия
- 2 Описательная неорганическая химия
- 2.1 Координационные соединения
- 2.2 Соединения основной группы
- 2.3 Соединения переходных металлов
- 2.4 Металлоорганические соединения
- 2.5 Кластерные соединения
- 2.6 Биоинорганические соединения
- 2.7 Соединения в твердом состоянии
- 3 Теоретическая неорганическая химия
- 3.1 Качественные теории
- 3.2 Молекулярная теория групп симметрии
- 4 Термодинамика и неорганическая химия
- 5 Механистическая неорганическая химия
- 5.1 Элементы основных групп и лантаноиды
- 5.2 Комплексы переходных металлов
- 5.2. 1 Редокс-реакции
- 5.2.2 Реакции лигандов
- 6 Характеристика неорганических соединений
- 7 Синтетическая неорганическая химия
- 8 См. Также
- 9 См. ences
Классификация неорганических веществ
Неорганические вещества
по составу делят напростые и сложные .
Простые вещества
состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом.
Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гидроксиды, соли.
- Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (—2). Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобрадующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды, кислоты соответственно.
- Основные оксиды — это оксиды металлов в степенях окисления +1 и +2. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы )Li — Fr
- оксиды металлов главной подгруппы второй группы (Mg и щелочноземельные металлы )Mg — Ra
- оксиды переходных металлов в низших степенях окисления
Кислотные оксиды —образуют неметаллы со С.О. более +2 и металлы со С.О. от +5 до +7 (SO2, SeO2, Р2O5, As2O3, СO2, SiO2, CrO3 и Mn2O7).Исключение: у оксидов NO2и ClO2нет соответствующих кислотных гидроксидов, но их считают кислотными.
Амфотерные оксиды — образованы амфотерными металлами со С.О. +2, +3,+4 (BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО).
Несолеобразующие оксиды — оксиды неметаллов со С.О.+1, +2 (СО, NO, N2O, SiO).
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-ОН). Общая формула оснований: М(ОН)у, где у — число гидроксогрупп, равное степени окислении металла М (как правило, +1 и +2). Основания делятся на растворимые (щелочи) и нерастворимые.
Кислоты — (кислотные гидроксиды) — это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Общая формула кислот: НхАс, где Ас — кислотный остаток (от английского «acid» — кислота), х — число атомов водорода, равное заряду иона кислотного остатка.
Амфотерные гидроксиды — это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме кислот, и в форме оснований.
Соли — это сложные вещества, состоящие из катионов металла и анионов кислотных остатков. Такое определение относится к средним солям.
Средние соли — это продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Чтобы правильно назватькислую соль, необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.Например, KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия. Нужно помнить, что кислые соли могут образовывать только двух и более основные кислоты.
Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Чтобы назватьосновную соль, необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН – групп, входящих в состав соли.Например, (CuOH)2CO3 – гидроксокарбонат меди (II).Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Например, KAl(SO4)2, KNaSO4.
Смешанные соли — в их составе присутствует два различных аниона. Например, Ca(OCl)Cl.
Гидратные соли (кристаллогидраты ) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4 ·10H2O.
Классификация неорганических соединений
Неорганические вещества: определение и примеры
В природе существует огромное количество неорганических веществ. Одним из наиболее распространенных примеров является вода (H2O), которая состоит из атомов водорода и кислорода. Вода является неотъемлемой частью жизни на Земле и играет важную роль во многих химических реакциях.
Еще одним примером неорганического вещества является камень. Камни могут иметь различную химическую структуру и свойства в зависимости от их состава. Они используются в строительстве, производстве украшений и многих других областях.
Также неорганическим веществом является соль. Соли образуются при реакции между кислотами и основаниями и широко используются в пищевой промышленности, медицине, сельском хозяйстве и других отраслях.
Вновь описанные примеры лишь небольшая часть множества неорганических веществ, существующих в природе и созданных человеком. Сколько неорганических веществ существует точно, сложно сказать, так как количество их просто несметное.
Определение неорганических веществ
Всего существует огромное количество неорганических веществ, которые отличаются от органических веществ тем, что не содержат атомы углерода. Неорганические вещества могут быть простыми или сложными соединениями, включая соли, оксиды, кислоты, основания и другие.
Определение неорганических веществ является важной задачей для химиков и научных исследователей. Изучение неорганических веществ позволяет понять их свойства, структуру и возможные применения в различных областях науки и промышленности
Неорганические вещества выполняют различные функции в природе, в технологических процессах и в жизни организмов. Например, неорганические вещества могут быть использованы в производстве удобрений, стекла, электроники, лекарств и многого другого.
Изучение и анализ неорганических веществ имеет важное значение для понимания химических процессов и развития новых технологий. Специалисты в области неорганической химии исследуют различные свойства и реакции неорганических соединений, что помогает создавать новые материалы и применения
Неорганические вещества представляют огромное разнообразие и имеют важное значение в химии и других областях науки и технологии. Их изучение позволяет расширить наши знания о составе и свойствах мира, в котором мы живем, и способствует развитию новых материалов и технологий
Примеры неорганических веществ
Неорганические вещества представляют собой химические соединения, состоящие из элементов, отличных от углерода. Всего существует огромное количество неорганических веществ, некоторые из них включают:
- Вода (H2O) — одно из наиболее известных и распространенных неорганических веществ, состоящих из атомов водорода и кислорода.
- Сода (NaHCO3) — соль натрия, широко используемая в быту и пищевой промышленности.
- Серная кислота (H2SO4) — одна из самых сильных кислот, широко применяемая в промышленности.
- Аммиак (NH3) — безцветный газ, используемый в качестве удобрения и сырья в химической промышленности.
- Карбонат кальция (CaCO3) — основной компонент мрамора и известняка.
Это лишь небольшой перечень примеров неорганических веществ, которые существуют в природе и используются человеком в различных отраслях промышленности и повседневной жизни.
Сложные вещества
Вещества, образованные из атомов двух и более химических элементов, называют сложными. Например, каждая молекула воды содержит два атома водорода и один атом кислорода. Ее состав обозначают записью H2O, который читается «аш-два-о».
Другим примером сложных веществ является углекислый газ. Его выдыхают все живые организмы, а растениям он нужен для питания. Молекула углекислого газа образована одним атомом углерода и двумя атомами кислорода. Этот состав молекулы отражают записью СО2, который читается «це о два».
Почему сложных веществ больше, чем простых?
Ученые доказали, что атомы различных химических элементов способны соединяться друг с другом в разном количестве и последовательности. Подобно тому, как в языке сочетанием букв образуется разнообразие слов, сочетанием различных атомов и в разном количестве образовалось более 10000000 веществ. Так что неудивительно, что сложных веществ существует гораздо больше, чем простых.
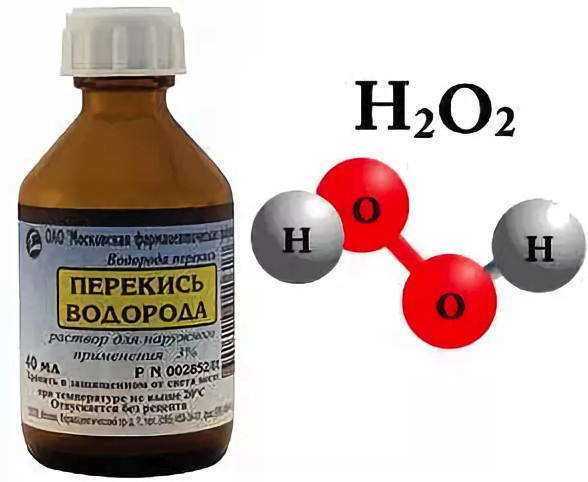
Рассмотрим еще раз рисунок и увидим, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Из таких же атомов состоит и вещество водород пероксида, однако она имеет совсем другие свойства, чем вода. Например, водород пероксида имеет температуру кипения выше на 50°С, обладает обеззараживающими свойствами. Ни одна аптечка не обходится без него, ведь раствором этого вещества под названием «перекись водорода» обрабатывают раны, чтобы они быстрее заживали. Такие отличные от воды свойства перекиси водорода обусловленные различиями в строении его молекулы. Ведь молекула этого вещества состоит из двух атомов водорода и двух атомов кислорода.
Основные классы неорганических соединений
Неорганическими называют соединения, которые не содержат углерод. Также в порядке исключения к ним относят некоторые вещества на основе углерода: карбонаты, карбиды, карбонилы металлов, цианиды и цианаты, оксиды углерода.
Неорганические соединения разделяют на простые (содержат атомы одного элемента) и сложные (образуются из атомов двух и более элементов).
Простые и сложные вещества также подразделяют на классы.
Классы простых веществ — это металлы, неметаллы, амфотерные вещества и благородные газы.
Классы сложных неорганических веществ — основания, оксиды, кислоты и соли.
Удивительные научные открытия:
Современная наука не перестает удивлять нас своими открытиями и достижениями. В частности, в сфере изучения неорганических веществ были совершены невероятные открытия, которые кардинально изменили наше представление о мире.
Одним из самых поразительных открытий является синтез трансурановых элементов, которые находятся за пределами периодической системы Менделеева. Группа ученых из Дубны (Россия) и Дармштадта (Германия) создала такие элементы, как майтнерий, дармштадтий и рентгений. Это невероятное достижение позволяет нам лучше понять структуру и свойства атомов, а также открыть новые возможности в различных отраслях науки и техники.
Другим удивительным открытием было создание синтетического алмаза. Ученые разработали методы получения алмазов в лабораторных условиях, что помогло раскрыть множество интересных свойств этого драгоценного камня. Синтетические алмазы не только могут быть использованы в ювелирной промышленности, но также находят применение в науке, электронике и многих других областях.
Одним из самых новейших и поразительных открытий является создание искусственного элемента под названием «унунпентий» (элемент с атомным номером 115). Ученые из Института ядерных исследований Дубны и Ливерморской национальной лаборатории синтезировали этот элемент впервые в 2003 году. Унунпентий обладает уникальными свойствами и является самым тяжелым элементом, полученным искусственным путем на данный момент.
Такие удивительные научные открытия преподносят нам новые знания о мире неорганических веществ и показывают, насколько разнообразен и удивителен наш мир.
Слайд 8 Серная кислота Нет ни одной отрасли химической
промышленности, где бы ни находила применение серная кислота.Серная кислота применяется на том или ином этапе получения почти любого продукта. Серная кислота
Производство искусственныхминеральных удобренийфосфорнокислого азотного удобрения удобрения(суперфосфата) (сернокислого аммония)
Производство кислотИзготовление взрывчатых веществПолучение сернокислых солейОчистка бензина, керосина, смазочных маселЗарядка свинцовых аккумуляторов
Применяется в металлообрабатывающей промышленности (в виде травильных растворов) для снятия окалины и загрязнения с металлических изделий перед окраской или покрытием другими металлами
См. далее

2.1. Классификация и номенклатура неорганических веществ
Неорганические вещества по составу принято делить на две группы: немногочисленную группу простых веществ (их насчитывается около 400) и очень многочисленную группу сложных веществ. Простые вещества состоят из одного химического элемента, а сложные — из нескольких.
Все простые вещества можно разделить на металлы и неметаллы, поскольку их свойства существенно отличаются. Металлы обладают металлическим блеском, высокой тепло- и электропроводностью, пластичны, проявляют восстановительные свойства. Неметаллы обладают очень разными физическими и химическими свойствами, но, как правило, в твердом состоянии хрупкие, плохо проводят электрический ток и тепло.
Сложные вещества обычно делят на классы: оксиды, кислоты, основания, амфотерные гидроксиды и соли. Данная классификация несовершенна, т. к. в ней нет места для аммиака, соединений металлов с фосфором, азотом, углеродом и т. д.
Классификация неорганических веществ
Оксиды
|
Основные |
Амфотерные |
Кислотные |
|
Ме в с.о. +1, +2 |
Ме в с.о. +3, +4 |
НеМе и Ме в с.о. +5, +6, +7 |
|
CaO |
Al2O3 |
Mn2O7 |
|
Na2O |
Cr2O3 |
Cl2O3 |
|
MgO |
Исключение: ZnO, BeO, SnO, PbO |
P2O5 |
Гидроксиды
|
Основные |
Амфотерные |
Кислоты |
|
Ме в с.о. +1, +2 |
Ме в с.о. +3, +4 |
НеМе и Ме в с.о. +5, +6, +7 |
|
NaOH |
Al(OH)3 |
H3PO4 |
|
KOH |
Cr(OH)3 |
H2SO4 |
|
Cr(OH)2 |
Исключение: Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
H2SO3 |
Соли
|
Средние |
NaCl |
|
Кислые |
Ca(HSO4)2 |
|
Комплексные |
Na[Al(OH)4] |
|
Основные |
CaOHCl |
|
Двойные |
KAl(SO4)2 |
Оксиды — это соединения двух элементов, один из которых кислород.
Общая формула оксидов: ЭnOm
n — число атомов элемента;
m — число атомов кислорода.
Основания — это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксильных групп — OH.
Общая формула оснований: Me(OH)x
x — число гидроксильных групп, равное валентности металла Me.
Кислоты — это сложные вещества, состоящие из атомов водорода, способных замещаться на металлы, и кислотных остатков. Кислоты можно разделить на группы по содержанию кислорода: кислородосодержащие (например, HNO3, H2SO4, H3PO4) и бескислородные (HI, H2S).
Амфотерные гидроксиды — это сложные вещества, которые имеют свойства кислот и свойства оснований.
Формулы амфотерных гидроксидов можно записывать в форме оснований и в форме кислот:
Zn(OH)2 = H2ZnO2;
Al(OH)3 = H3AlO3.
Соли – это продукты замещения атомов водорода в молекулах кислот атомами металла или это продукты замещения гидроксильных групп в молекулах оснований кислотными остатками.
Номенклатура
Оксиды:
Название оксида = «оксид» + название элемента + валентность элемента.
Например:
CO — оксид углерода (II);
CO2 – оксид углерода (IV);
Fe2O3 – оксид железа (III).
Гидроксиды (основания):
Название основания = «гидроксид» + название металла + валентность элемента.
Например:
Fe(OH)2 – гидроксид железа (II);
Ca(OH)2 – гидроксид кальция;
NaOH – гидроксид натрия.
Кислоты:
Бескислородные кислоты:


Формулы и названия бескислородных кислот и кислотных остатков
|
Формула кислоты |
Название кислоты |
Кислотный остаток |
Название кислотного остатка |
|
HF |
Фтороводородная кислота |
-F |
Фторид |
|
HCl |
Хлороводородная кислота |
-Cl |
Хлорид |
|
HBr |
Бромоводородная кислота |
-Br |
Бромид |
|
HI |
Иодоводородная кислота |
-I |
Йодид |
|
H2S |
Циановодородная кислота |
=S |
Сульфид |
|
HCN |
Циановодородная кислота |
-CN |
Цианид |
Кислородсодержащие кислоты:
Если один элемент образует две оксокислоты, то суффиксы –н или –ов используются в названии кислоты с большей валентностью элемента, а суффиксы –ист или –нист – в названии кислоты с наименьшей валентностью элемента.
Формулы и названия кислородсодержащих кислот и кислотных остатков
|
Формула кислоты |
Название кислоты |
Кислотный остаток |
Название кислотного остатка |
|
H2CO3 |
Угольная кислота |
=CO3 |
Карбонат |
|
H2SiO3 |
Кремниевая кислота |
=SiO3 |
Силикат |
|
HNO3 |
Азотная кислота |
-NO3 |
Нитрат |
|
HNO2 |
Азотистая кислота |
-NO2 |
Нитрит |
|
H3PO4 |
Фосфорная кислота |
PO4 |
Фосфат |
|
H3PO3 |
Фосфористая кислота |
PO3 |
Фосфит |
|
H2SO4 |
Серная кислота |
=SO4 |
Сульфат |
|
H2SO3 |
Сернистая кислота |
=SO3 |
Сульфит |
|
H2CrO4 |
Хромовая кислота |
=CrO4 |
Хромат |
|
H2Cr2O7 |
Дихромовая кислота |
=Cr2O7 |
Дихромат |
|
HClO |
Хлорноватистая кислота |
-ClO |
Гипохлорит |
|
HClO2 |
Хлористая кислота |
-ClO2 |
Хлорит |
|
HClO3 |
Хлорноватая кислота |
-ClO3 |
Хлорат |
|
HClO4 |
Хлорная кислота |
-ClO4 |
Перхлорат |
|
H2MnO4 |
Марганцовистая кислота |
=MnO4 |
Манганат |
|
HMnO4 |
Марганцовая кислота |
-MnO4 |
Перманганат |
Соли:
Средние соли:
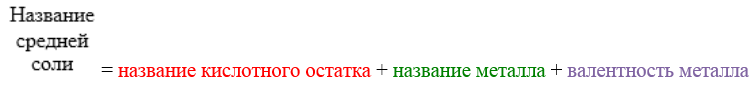
Например:
NaCl — хлорид натрия;
Fe(NO3)2 — нитрат железа (II).
Кислые соли:

Например:
NaHCO3 — гидрокарбонат натрия;
FeHPO4 — гидрофосфат железа (II).
Основные соли:
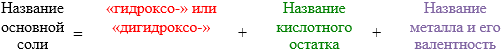 .
.
Например:
CaOHCl — гидроксохлорид кальция;
FeOH(NO3)2 — гидроксонитрат железа (III).
Прочитано
Отметь, если полностью прочитал текст
Растущая популярность и изучение:
В настоящее время существует огромный интерес к изучению неорганических веществ. Ученые со всего мира проводят многочисленные исследования и эксперименты, чтобы расширить наши знания об этом удивительном классе веществ.
Одной из причин такого большого интереса является потенциальное применение неорганических веществ в различных областях, таких как электроника, катализаторы, магнитные материалы, солнечные батареи и многое другое. Исследования в этой области могут привести к разработке новых материалов и технологий, которые могут значительно улучшить нашу жизнь и привнести новые возможности и открытия.
Изучение неорганических веществ также помогает ученым понять основы химических процессов и реакций, а также развить новые методы синтеза, анализа и модификации материалов
Это дает возможность создавать уникальные структуры и свойства, которые могут иметь важное значение для различных научных и промышленных областей
С каждым годом число известных неорганических веществ постоянно растет. По последним оценкам, в настоящее время номеров CAS (Chemical Abstracts Service), присвоенных неорганическим веществам, уже более 2 миллионов. Это свидетельствует о нашем все более глубоком понимании мира неорганической химии и постоянной активности ученых и исследователей в этой области.
Объем знаний и возможностей, связанных с неорганическими веществами, растет с каждым днем, и это открывает перед нами новые перспективы и горизонты. В будущем, благодаря продолжающимся исследованиям, мы, возможно, сможем разгадать еще больше загадок и узнаем о новых свойствах и применениях неорганических веществ, которых на данный момент даже не представляем.
| Статистика | |
|---|---|
| Количество известных неорганических веществ | Более 2 миллионов |
Количество известных соединений:
Сколько известно неорганических химических соединений? Это вопрос, на который невозможно дать точный ответ.
На данный момент известно огромное количество химических соединений, но точное число неизвестно. Непрерывное развитие науки и постоянные исследования в области химии приводят к открытию новых соединений каждый день.
Все химические соединения могут быть поделены на две крупные категории: органические и неорганические. Органические соединения включают в себя соединения, которые содержат углерод, в то время как неорганические соединения состоят из других элементов.
Известно огромное количество неорганических химических соединений, таких как оксиды, соли, кислоты и многие другие. Они имеют различные свойства и применяются во многих областях науки и промышленности.
Несмотря на то, что точное число известных неорганических химических соединений неизвестно, существует множество каталогов и баз данных, которые содержат информацию о многих из них. Например, Chemical Abstracts Service (CAS) является известной базой данных, содержащей информацию о химических соединениях.
Важно отметить, что новые соединения продолжают открываться и исследоваться, что делает химию одной из самых динамичных и интересных областей науки
Основные группы неорганических соединений
В настоящее время известно огромное количество неорганических химических соединений. Их число с течением времени постоянно увеличивается благодаря развитию науки и технологий. Однако основные группы неорганических соединений можно выделить следующим образом:
- Оксиды — соединения, состоящие из кислорода и другого элемента. Они образуются при соединении металлов с кислородом или неоксидными кислотами.
- Соли — соединения, образованные в результате реакции нейтрализации кислоты и основания. Соли состоят из катионов и анионов и обладают характерными свойствами.
- Галогениды — соединения, содержащие один из халогенов (фтор, хлор, бром, йод) и другие элементы. Они часто используются в различных отраслях промышленности.
- Сульфиды — соединения, в которых сера соединена с другим элементом. Сульфиды имеют разнообразные свойства и находят применение в различных сферах, в том числе в строительстве и энергетике.
- Нитриды — соединения, состоящие из азота и других элементов. Они широко используются в производстве различных материалов, например, в полупроводниковой промышленности.
Это лишь некоторые из основных групп неорганических соединений. Каждая из них имеет свои особенности и применение. Благодаря своим свойствам и возможностям они играют важную роль в различных областях науки и промышленности.
Существующие оценки количества существующих соединений
Сколько химических соединений известно в области неорганической химии — вопрос, который вызывает ученых большой интерес. Изучение свойств и состава этих соединений позволяет понять многочисленные аспекты мира неживой природы.
Точного ответа на вопрос «сколько всего неорганических химических соединений известно» не существует, потому что каждый день наука делает новые открытия и расширяет свои границы. Однако существуют оценки, основанные на количестве известных и исследованных соединений, которые позволяют приблизительно представить масштабы этой области химии.
Одной из таких оценок является количество изученных и зарегистрированных неорганических химических соединений. На текущий момент эта цифра превышает несколько миллионов. Однако это лишь малая часть от общего количества, которое может существовать. Множество новых соединений еще не открыто и требует дальнейшего исследования.
Для некоторых элементов периодической системы известно огромное количество соединений. Например, углерод является одним из самых изученных элементов и число его соединений составляет несколько миллионов. Также большое число соединений обнаружено для элементов, таких как кислород, водород, азот и фосфор.
Оценить общее количество неорганических химических соединений крайне трудно из-за комбинаторной природы химических связей и возможных вариаций. Каждое соединение может иметь множество форм, изомеров и молекулярных конфигураций. Благодаря этому неорганическая химия предлагает безграничные возможности для исследования новых комплексов и соединений.
В итоге, сколько химических соединений известно в области неорганической химии — сложный вопрос без конкретного ответа. Но ученые продолжают свои исследования, расширяя границы нашего знания и открывая новые молекулярные соединения.
Простые вещества
Простыми называются соединения, состоящие из одного элемента (например, С-углерод, В-бор или Al-аллюминий). Атомы этих веществ соединены металлической или ковалентной связью. Основные классы — это металлы и неметаллы.
Металлы (восстановители)
Металлами называются элементы, обладающие восстановительными свойствами (то есть они стремятся отдавать свои электроны), атомы в составе которых соединяются металлической связью.
Физические признаки:

- пластичные;
- твердые;
- проводят электричество;
- проводят тепло;
- имеют блеск (поэтому их можно отличить по внешнему виду);
- плавятся и кипят.
Химические свойства проявляются в реакции со следующими веществами:
- неметаллами;
- солями;
- кислотами;
- водой.
При реакции с металлами, которые стоят в ряду активности металлов до алюминия, образуется щелочь и Н₂. При реакции с элементами, которые находятся между алюминием и водородом, образуется оксид металла и Н₂. Реакция со стоящими после водорода металлами не идет.
Неметаллы (окислители)
Неметаллы — это окислители. Какой бы ни была активность вещества, оно стремится принимать электроны. Атомы в соединениях неметаллов связаны ковалентной связью. Основные признаки:

- Могут иметь 3 агрегатных состояния: газы (водород, кислород, гелий, хлор, азот и другие), жидкости (бром), твердые тела (сера, фосфор, углерод).
- Металлический блеск отсутствует.
- Не проводят электричество (кроме черного фосфора и графита).
- Не проводят тепло (кроме графита).
- Низкая температура кипения.
Химические свойства неметаллов:
- вступают в реакцию с металлами;
- взаимодействуют с неметаллами;
- реагируют со сложными веществами (кислотами, солями, щелочами, оксидами).
Заключение
Вот так на мгновение мы окунулись в безграничный мир неорганической химии, которая оказалась не такой уж «неживой», а напротив, дышащей и активно растущей областью химической науки. Исходя из простой логики координационных соединений, мы увидели прямую связь неорганической химии с искусством, нанотехнологиями, кристаллами, органическими молекулами и живыми системами. Все это бесчисленное разнообразие вновь доказывает, насколько разносторонней является химическая наука, без которой не обойтись во многих научных и технологических начинаниях: будь то разработка лекарств, современных гаджетов или же создание красивейших красок для будущих шедевров.
Фонд «Beyond Curriculum» публикует цикл материалов «В чем прелесть предмета» в партнерстве с проектом «Караван знаний» при поддержке компании «Шеврон». Караван знаний – инициатива по исследованию и обсуждению передовых образовательных практик с участием ведущих казахстанских и международных экспертов.