Ферменты.
Ферменты – это природные катализаторы, регулирующие биохимические процессы в живой клетке. Они участвуют в процессах энергообмена, расщеплении питательных веществ, реакциях биосинтеза. Без них не могут протекать многие сложные органические реакции. Ферменты функционируют при обычных температуре и давлении, обладают очень высокой селективностью и способны увеличивать скорость реакций на восемь порядков. Несмотря на эти преимущества, лишь ок. 20 из 15 000 известных ферментов применяются в широких масштабах.
Человек тысячелетиями использовал ферменты при выпечке хлеба, получении алкогольных напитков, сыра и уксуса. Сейчас ферменты применяются и в промышленности: при переработке сахара, получении синтетических антибиотиков, аминокислот и белков. Протеолитические ферменты, ускоряющие процессы гидролиза, добавляют в детергенты.
С помощью бактерий Clostridium acetobutylicum
Х.Вейцман осуществил ферментативное превращение крахмала в ацетон и бутиловый спирт. Этот способ получения ацетона широко использовался в Англии во время Первой мировой войны, а во время Второй мировой войны с его помощью в СССР изготавливали бутадиеновый каучук.
Исключительно большую роль сыграло применение ферментов, продуцируемых микроорганизмами, для синтеза пенициллина, а также стрептомицина и витамина B 12 .
Этиловый спирт, получаемый ферментативным путем, широко используют в качестве автомобильного топлива. В Бразилии более трети из примерно 10 млн. автомобилей работают на 96%-ном этиловом спирте, получаемом из сахарного тростника, а остальные – на смеси бензина и этилового спирта (20%). Хорошо отработана технология производства топлива, представляющего собой смесь бензина и спирта, в США. В 1987 из зерен кукурузы было получено ок. 4 млрд. л спирта, из них примерно 3,2 млрд. л было использовано в качестве топлива. Разнообразное применение находят и т.н. иммобилизованные ферменты. Эти ферменты связаны с твердым носителем, например силикагелем, над которым пропускают реагенты. Преимущество этого метода состоит в том, что он обеспечивает эффективное контактирование субстратов с ферментом, разделение продуктов и сохранение фермента. Один из примеров промышленного использования иммобилизованных ферментов – изомеризация D-глюкозы во фруктозу.
Аммиак.
Один из самых простых с химической точки зрения процессов гидрирования – синтез аммиака из водорода и азота. Азот весьма инертное вещество. Для разрыва связи N–N в его молекуле необходима энергия порядка 200 ккал/моль. Однако азот связывается с поверхностью железного катализатора в атомарном состоянии, и для этого нужно всего 20 ккал/моль. Водород связывается с железом еще более охотно. Синтез аммиака протекает следующим образом:
Этот пример иллюстрирует способность катализатора ускорять в равной степени как прямую, так и обратную реакцию, т.е. тот факт, что катализатор не изменяет положение равновесия химической реакции.
↑нРЙПШРХЕ ЪБКЕМХЪ ЙЮРЮКХГЮ
еЫ╦ Б XV БЕЙЕ ЮКУХЛХЙХ НАМЮПСФХКХ, ВРН ЩРХКНБШИ ЯОХПР Б ОПХЯСРЯРБХХ ЯЕПМНИ ЙХЯКНРШ, ЙНРНПЮЪ МЕ ПЮЯУНДСЕРЯЪ, ОПЕБПЮЫЮЕРЯЪ Б ДХЩРХКНБШИ ЩТХП. б 1806 Ц. ТПЮМЖСГЯЙХЕ СВ╦МШЕ м.йКЕЛЮМ Х ь.дЕГНПЛ НРЙПШКХ ПЕЮЙЖХЧ ЙЮРЮКХРХВЕЯЙНЦН НЙХЯКЕМХЪ ЯЕПМХЯРНЦН ЮМЦХДПХДЮ ДН ЯЕПМНЦН Б ОПХЯСРЯРБХХ ДХНЙЯХДЮ ЮГНРЮ. к.рЕМЮП Б 1813 Ц. СЯРЮМНБХК, ВРН ЮЛЛХЮЙ ОПХ МЮЦПЕБЮМХХ ПЮГКЮЦЮЕРЯЪ МЮ ЮГНР Х БНДНПНД ОНД БКХЪМХЕЛ МЕЙНРНПШУ ЛЕРЮККНБ (ФЕКЕГН, ЛЕДЭ, ЯЕПЕАПН, ОКЮРХМЮ). мН РЕПЛХМ «ЙЮРЮКХГ» (НР ЦПЕВ. καταλύειν — ПЮГПСЬЕМХЕ) ББЕД╦М РНКЭЙН Б 1835 Ц. и.аЕПЖЕККХСЯНЛ, ЙНРНПШИ ЯХЯРЕЛЮРХГХПНБЮК Х НАНАЫХК БЯЕ ХГБЕЯРМШЕ Й ЩРНЛС БПЕЛЕМХ ЯБЕДЕМХЪ НА СЯЙНПЕМХХ УХЛХВЕЯЙХУ ПЕЮЙЖХИ ОНД ДЕИЯРБХЕЛ ЙЮРЮКХГЮРНПНБ.
Катализаторы
Перед изучением влияния катализаторов необходимо ознакомиться с некоторыми терминами. Катализаторы – вещества, которые ускоряют химическую реакцию, но не участвуют в ней.
Катализ – процесс изменения скорости реакции катализатором. Это слово в переводе с греческого означает «разрушение». Это разрушение длинного пути протекания реакции. Каталитические реакции – реакции, протекающие с участием катализатора.
Г. И. Гесс – российский учёный, который первый исследовал действие катализаторов. Результатом его работы является статья «О свойстве весьма мелко раздробленной платины способствовать соединению кислорода с водородом и о плотности платины». Сейчас известно большее число катализаторов. Они широко применяются в промышленности для увеличения скорости и выхода реакции.
Катализаторы существуют и в мире биохимии. Катализаторами белковой природы являются ферменты. Эти катализаторы, в отличие от неорганических, действуют в определённом интервале температур. За их пределами они разрушаются. По этой причине следует варить суп определённым способом, чтобы не уничтожить важные ферменты при варке растительных компонентов. Также из-за этого в инструкциях стиральных порошков с ферментами (энзимах) рекомендуют придерживаться определённой температуры.
Ферменты имеют очень важное значение в организме. Благодаря им происходит расщепление белков, жиров и углеводов
Ферменты расщепляют вредоносные включения организма. Кроме катализаторов есть ингибиторы – вещества, которые замедляют протекание химической реакции. Они используются для предотвращения коррозии и в других целях.
Классификация химических реакций на основании их признаков.
|
в результате таких реакций из двух или более исходных веществ образуется только один продукт, например: С + O2 = CO2 4NO2 + O2 + 2H2O = 4HNO3 |
|
|
в таких реакциях из одного вещества образуется два или больше других веществ: 2KMnO4 = K2MnO4 + MnO2 + O2 CaCO3 = CaO + CO2 |
|
замещенияВсе реакции, в результате которых из простого и сложного веществ образуется другое простое и другое сложное вещества. Например: Zn + CuSO4 = ZnSO4 + Cu В органической химии, под реакциями замещения подразумевают также такие реакции, в результате которых происходит замена атома водорода или заместителя прикрепленного к углеродному скелету молекулы, на другой заместитель. Подробнее — в таблице ниже посвященной классификации реакций в органической химии. |
|
обменаРеакциями обмена называют такие реакции, в результате которых вещества меняются своими составными частями. Например: 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 Частный случай реакции обмена между кислотой и основанием носит также название реакции нейтрализации: NaOH + HCl = NaCl + H2O многие реакции органической химии, в которых вещества меняются своими составными частями относят к реакциям замещения. Подробнее — в таблице ниже посвященной классификации реакций в органической химии. |
|
обратимыетакие реакции обладают способностью протекать как в прямом, так и обратном направлении. Реакции, про которые обязательно нужно знать, что они обратимые: |
|
необратимыеТакие реакции протекают только в прямом направлении. Если речь идет о реакциях между электролитами, то необратимой реакция является в том случае, если образуется осадок, газ или малодиссоциирующее вещество. Например: Na2CO3 + 2HCl = 2NaCl + H2O + CO2 В качестве малодиссоциирующих веществ в реакциях ионного обмена могут образоваться вода, слабые кислоты, гидроксид аммония. |
|
экзотермическиеВ результате таких реакций выделяется энергия в виде теплоты. Обозначают такие реакции, добавляя «+Q» к уравнению реакции, например: |
|
эндотермическиеПри протекании таких реакций поглощается тепло. Для обозначения таких реакций пишут «-Q» в уравнении реакции. Практически все реакции разложения являются эндотермическими: Исключения: реакции разложения HI и NO являются экзотермическими. |
|
гомогенныеГомогенными реакциями называют такие реакции, реагенты в которых находятся в одной фазе. Примерами таких реакций могут быть многие реакции протекающие в растворах, реакции между газообразными веществами: NaOH (р-р) + HCl(р-р) = NaCl + H2O 2CO + O2 = 2CO2 В гомогенных реакциях не наблюдаются границы раздела между реагентами |
|
гетерогенныегетерогенными реакциями называют такие реакции, в которых реагирующие вещества находятся в разных фазах. Примерами таких реакций являются, взаимодействие цинка с раствором соляной кислоты, взаимодействие углекислого газа с известковой водой, и т.д.:
|
|
↑ тЕПЛЕМРЮРХБМШИ ЙЮРЮКХГ
тЕПЛЕМРЮРХБМШИ ЙЮРЮКХГ (АХНЙЮРЮКХГ) – ЩРН СЯЙНПЕМХЕ АХНУХЛХВЕЯЙХУ ПЕЮЙЖХИ ОНД ДЕИЯРБХЕЛ АЕКЙНБШУ ЛЮЙПНЛНКЕЙСК, МЮГШБЮЕЛШУ ТЕПЛЕМРЮЛХ ХКХ ЩМГХЛЮЛХ. бЮФМЕИЬХЕ НЯНАЕММНЯРХ ТЕПЛЕМРЮРХБМНЦН ЙЮРЮКХГЮ – ЩТТЕЙРХБМНЯРЭ Х ЯОЕЖХТХВМНЯРЭ. тЕПЛЕМРШ СБЕКХВХБЮЧР ЯЙНПНЯРЭ УХЛХВЕЯЙНЦН ОПЕБПЮЫЕМХЪ ЯСАЯРПЮРЮ ОН ЯПЮБМЕМХЧ Я МЕТЕПЛЕМРЮРХБМНИ ПЕЮЙЖХЕИ Б 109 — 1012 ПЮГ. яРНКЭ БШЯНЙЮЪ ЩТТЕЙРХБМНЯРЭ НАСЯКНБКЕМЮ НЯНАЕММНЯРЪЛХ ЯРПНЕМХЪ ЮЙРХБМНЦН ЖЕМРПЮ. оПХМЪРН ЯВХРЮРЭ, ВРН ЮЙРХБМШИ ЖЕМРП ЙНЛОКЕЛЕМРЮПЕМ (ОПНЯРПЮМЯРБЕММНЕ ЯННРБЕРЯРБСЕР) ОЕПЕУНДМНЛС ЯНЯРНЪМХЧ ЯСАЯРПЮРЮ ОПХ ОПЕБПЮЫЕМХХ ЕЦН Б ОПНДСЙР. аКЮЦНДЮПЪ ЩРНЛС ЯРЮАХКХГХПСЕРЯЪ ОЕПЕУНДМНЕ ЯНЯРНЪМХЕ Х ОНМХФЮЕРЯЪ ЩМЕПЦХЪ ЮЙРХБЮЖХХ. лМНЦХЕ ТЕПЛЕМРШ НАКЮДЮЧР БШЯНЙНИ ЯСАЯРПЮРМНИ ЯОЕЖХТХВМНЯРЭЧ, Р.Е. ЯОНЯНАМНЯРЭЧ ЙЮРЮКХГХПНБЮРЭ ОПЕБПЮЫЕМХЕ РНКЭЙН НДМНЦН ХКХ МЕЯЙНКЭЙХУ АКХГЙХУ ОН ЯРПСЙРСПЕ БЕЫЕЯРБ. яОЕЖХТХВМНЯРЭ НАСЯКЮБКХБЮЕРЯЪ ЯРПНЕМХЕЛ ЯБЪГШБЮЧЫЕЦН ЯСАЯРПЮР СВЮЯРЙЮ ЮЙРХБМНЦН ЖЕМРПЮ.
тЕПЛЕМРЮРХБМШИ ЙЮРЮКХГ – НЯМНБЮ ЛМНЦХУ ЯНБПЕЛЕММШУ РЕУМНКНЦХИ, Б ВЮЯРМНЯРХ ЙПСОМНЛЮЯЬРЮАМШУ ОПНЖЕЯЯНБ ОНКСВЕМХЪ ЦКЧЙНГШ Х ТПСЙРНГШ, ЮМРХАХНРХЙНБ, ЮЛХМНЙХЯКНР, БХРЮЛХМНБ, Ю РЮЙФЕ МЕЙНРНПШУ ОПНЖЕЯЯНБ РНМЙНЦН НПЦЮМХВЕЯЙНЦН ЯХМРЕГЮ. бЮФМШЛ ДНЯРНХМЯРБНЛ АХНЙЮРЮКХГЮ ЪБКЪЕРЯЪ РН, ВРН НМ, Б НРКХВХЕ НР ЛМНЦХУ ОПНЛШЬКЕММШУ ЙЮРЮКХРХВЕЯЙХУ ОПНЖЕЯЯНБ, ПЕЮКХГСЕРЯЪ ОПХ НАШВМНЛ ДЮБКЕМХХ Х Б ХМРЕПБЮКЕ РЕЛОЕПЮРСП НР ЙНЛМЮРМНИ ДН 50 Ня. щРН ОНГБНКЪЕР ОПХМЖХОХЮКЭМН ЯМХГХРЭ ГЮРПЮРШ ЩМЕПЦХХ. й ЯНФЮКЕМХЧ, ТЕПЛЕМРШ ЯОНЯНАМШ ЙЮРЮКХГХПНБЮРЭ ОПЕБПЮЫЕМХЪ РНКЭЙН РЕУ УХЛХВЕЯЙХУ ЯНЕДХМЕМХИ, ЙНРНПШЕ СВЮЯРБСЧР Б ЛЕРЮАНКХГЛЕ, ОНЩРНЛС АХНЙЮРЮКХГ МЕ ЛНФЕР ХЯОНКЭГНБЮРЭЯЪ ДКЪ ЯХМРЕГЮ ВСФДШУ ФХБНЛС НПЦЮМХГЛС БЕЫЕЯРБ, Ю РЮЙХУ АНКЭЬХМЯРБН.
ПРИМЕНЕНИЕ КАТАЛИЗА В ПРОМЫШЛЕННОСТИ
Тот бурный промышленный рост, который мы сейчас переживаем, был бы невозможен без развития новых химических технологий. В значительной мере этот прогресс определяется широким применением катализаторов, с помощью которых низкосортное сырье превращается в высокоценные продукты. Образно говоря, катализатор – это философский камень современного алхимика, только он превращает не свинец в золото, а сырье в лекарства, пластмассы, химические реактивы, топливо, удобрения и другие полезные продукты.
Пожалуй, самый первый каталитический процесс, который человек научился использовать, – это брожение. Рецепты приготовления алкогольных напитков были известны шумерам еще за 3500 до н.э. См
. ВИНО; ПИВО.
Значительной вехой в практическом применении катализа стало производство маргарина каталитическим гидрированием растительного масла. Впервые эта реакция в промышленном масштабе была осуществлена примерно в 1900. А начиная с 1920-х годов один за другим были разработаны каталитические способы получения новых органических материалов, прежде всего пластмасс. Ключевым моментом стало каталитическое получение олефинов, нитрилов, эфиров, кислот и т.д. – «кирпичиков» для химического «строительства» пластмасс.
Третья волна промышленного использования каталитических процессов приходится на 1930-е годы и связана с переработкой нефти. По своему объему это производство вскоре оставило далеко позади все другие. Переработка нефти состоит из нескольких каталитических процессов: крекинга, риформинга, гидросульфирования, гидрокрекинга, изомеризации, полимеризации и алкилирования.
И наконец, четвертая волна в использовании катализа связана с охраной окружающей среды. Наиболее известное достижение в этой области – создание каталитического нейтрализатора выхлопных газов автомобилей. Каталитические нейтрализаторы, которые устанавливают на автомобили с 1975, сыграли большую роль в улучшении качества воздуха и сберегли таким образом много жизней.
За работы в области катализа и смежных областей было присуждено около десятка Нобелевских премий.
О практической значимости каталитических процессов свидетельствует тот факт, что на долю азота, входящего в состав полученных промышленным путем азотсодержащих соединений, приходится около половины всего азота, входящего в состав пищевых продуктов. Количество соединений азота, образующихся естественным путем, ограничено, так что производство пищевого белка зависит от количества азота, вносимого в почву с удобрениями. Невозможно было бы прокормить и половину человечества без синтетического аммиака, который получают почти исключительно с помощью каталитического процесса Габера – Боша.
Область применения катализаторов постоянно расширяется
Важно и то, что катализ позволяет значительно повысить эффективность ранее разработанных технологий. В качестве примера можно привести усовершенствование каталитического крекинга благодаря использованию цеолитов
Ускорение химической реакции с помощью катализаторов
В процессе химической реакции катализатор взаимодействует с реагентами и образует промежуточные соединения, которые расщепляются, образуя конечные продукты. Именно на стадии образования промежуточных соединений катализатор оказывает наиболее сильное влияние на скорость реакции.
Катализаторы обладают специфичностью, то есть они работают только в определенных условиях и в присутствии определенных веществ (субстратов). Катализаторы могут быть разных типов: гетерогенные, если они находятся в различной фазе с реагентами, и гомогенные, если они находятся в одной фазе с реагентами. В зависимости от типа катализатора, процесс активации может различаться.
Катализаторы способны повысить скорость реакции путем:
- Повышения концентрации реагирующих веществ на поверхности катализатора, создавая условия для эффективного столкновения молекул.
- Снижения активации реагирующих веществ, тем самым снижая энергетический барьер и ускоряя образование продуктов.
- Изменения механизма реакции, образуя промежуточные соединения, которые являются более стабильными и могут легче распасться в конечные продукты.
Катализаторы имеют широкое применение в промышленности, биологии и других областях. Они позволяют значительно сократить время проведения реакции, повысить выход продуктов и обеспечить экономическую эффективность процесса. Без использования катализаторов многие химические реакции были бы длительными и неэффективными.
Использование катализаторов является одним из ключевых факторов в области химии и позволяет значительно ускорить химические реакции, что имеет широкие практические применения.
Стереоспецифическая полимеризация.
Важной вехой в истории катализа явилось открытие каталитической полимеризации a
-олефинов с образованием стереорегулярных полимеров. Катализаторы стереоспецифической полимеризации были открыты К.Циглером, когда он пытался объяснить необычные свойства полученных им полимеров
Другой химик, Дж.Натта, предположил, что уникальность полимеров Циглера определяется их стереорегулярностью. Эксперименты по дифракции рентгеновских лучей показали, что полимеры, полученные из пропилена в присутствии катализаторов Циглера, высококристалличны и действительно имеют стереорегулярную структуру. Для описания таких упорядоченных структур Натта ввел термины «изотактический» и «синдиотактический». В том случае, когда упорядоченность отсутствует, используется термин «атактический»:
Стереоспецифическая реакция протекает на поверхности твердых катализаторов, содержащих переходные металлы групп IVA–VIII (такие, как Ti, V, Cr, Zr), находящиеся в неполностью окисленном состоянии, и какое-либо соединение, содержащее углерод или водород, который связан с металлом из групп I–III. Классическим примером такого катализатора является осадок, образующийся при взаимодействии TiCl 4 и Al(C 2 H 5) 3 в гептане, где титан восстановлен до трехвалентного состояния. Эта исключительно активная система катализирует полимеризацию пропилена при обычных температуре и давлении.
Теории катализа.
Для объяснения механизма каталитических реакций были предложены три группы теорий: геометрические, электронные и химическая
В геометрических теориях основное внимание обращено на соответствие между геометрической конфигурацией атомов активных центров катализатора и атомов той части реагирующих молекул, которая ответственна за связывание с катализатором. Электронные теории исходят из представления, что хемосорбция обусловливается электронным взаимодействием, связанным с переносом заряда, т.е
эти теории связывают каталитическую активность с электронными свойствами катализатора. Химическая теория рассматривает катализатор как химическое соединение с характерными свойствами, которое образует химические связи с реагентами, в результате чего формируется нестабильный переходный комплекс. После распада комплекса с высвобождением продуктов катализатор возвращается в исходное состояние. Последняя теория считается сейчас наиболее адекватной.
На молекулярном уровне каталитическую газофазную реакцию можно представить следующим образом. Одна реагирующая молекула связывается с активным центром катализатора, а другая взаимодействует с ней, находясь непосредственно в газовой фазе. Возможен и альтернативный механизм: реагирующие молекулы адсорбируются на соседних активных центрах катализатора, а потом взаимодействуют друг с другом. По-видимому, именно таким образом протекает большинство каталитических реакций.
Другая концепция предполагает, что существует связь между пространственным расположением атомов на поверхности катализатора и его каталитической активностью. Скорость одних каталитических процессов, в том числе многих реакций гидрирования, не зависит от взаимного расположения каталитически активных атомов на поверхности; скорость других, напротив, существенно изменяется при изменении пространственной конфигурации поверхностных атомов. В качестве примера можно привести изомеризацию неопентана в изопентан и одновременный крекинг последнего до изобутана и метана на поверхности катализатора Pt-Al 2 O 3 .
Скорость гетерогенной реакции
В данной формуле вместо объема, мы учитываем площадь поверхности и получаем, что скорость равна изменению количества вещества на площадь поверхности раздела (S) за единицу времени (t)
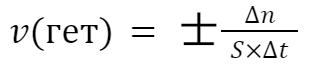
где S — площадь поверхности соприкосновения веществ
То, какой знак (плюс или минус) будет стоять перед выражением скорости, зависит от того, на изменение количества какого вещества мы смотрим — продукта или реагента.
Очевидно, что в ходе реакции происходит расход реагентов, то есть их количество уменьшается, следовательно, для них выражение (n2-n1) всегда имеет значение меньше нуля. Поскольку скорость не может быть отрицательной величиной, в этом случае перед выражение скорости мы ставим знак минус.
Если же мы смотрим на изменение количества продукта, то его количество в ходе реакции всегда увеличивается и перед выражением знак минус ставить не нужно, так как значение n в этом случае всегда положительно
Также стоит отметить, что скорость реакции не является постоянной величиной. Мы указываем лишь некоторую среднюю скорость данной реакции в определенном промежутке времени.
Роль катализаторов в экологически чистых технологиях
В последние десятилетия все большее внимание уделяется проблеме экологически чистых технологий, которые позволяют снизить негативное воздействие химических процессов на окружающую среду. В этом контексте, катализаторы играют ключевую роль, обеспечивая более эффективные и экологически безопасные реакции
Катализаторы в экологически чистых технологиях позволяют снизить количество используемых реагентов, что приводит к сокращению образования отходов и выбросов вредных веществ. Они способны ускорить химическую реакцию, тем самым позволяя ей происходить при более низких температурах и давлениях. Это становится возможным благодаря способности катализаторов значительно снижать энергетические затраты на проведение реакций.
Например, в процессе гидрогенирования органических соединений, катализаторы способны способствовать добавлению водорода в молекулу органического вещества. Такие процессы являются неотъемлемой частью производства различных химических соединений, таких как лекарственные препараты или пищевые добавки. Использование катализаторов позволяет проводить эти процессы с высокой степенью селективности и эффективности, что способствует снижению количества сырья и энергии, требуемых для производства.
Кроме того, катализаторы находят применение в очистке выбросов промышленных предприятий. Например, катализаторы в автомобильных катализаторах способны улавливать и превращать в безопасные вещества отходы сгорания автомобильного топлива. Это позволяет снизить выбросы вредных веществ, таких как оксиды азота или углеводороды, в атмосферу, делая выбросы автомобилей более экологически безопасными.
Таким образом, катализаторы играют важную роль в создании и развитии экологически чистых технологий. Они способствуют снижению негативного влияния химических процессов на окружающую среду, позволяя проводить реакции с меньшим количеством отходов и выбросов. Это делает катализаторы неотъемлемым элементом устойчивого развития и экологической безопасности.
ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ
Современные технологии невозможно представить без применения катализаторов. Каталитические реакции могут протекать при температурах до 650°
С и давлениях 100 атм и более. Это заставляет по-новому решать проблемы, связанные с контактированием между газообразными и твердыми веществами и с переносом частиц катализатора. Чтобы процесс был эффективным, при его моделировании необходимо учитывать кинетические, термодинамические и гидродинамические аспекты. Здесь широко используются компьютерное моделирование, а также новые приборы и методы контроля за технологическими процессами.
В 1960 был достигнут значительный прогресс в производстве аммиака. Применение более активного катализатора позволило понизить температуру получения водорода при разложении водяного пара, благодаря чему удалось понизить давление и, следовательно, уменьшить производственные затраты, например за счет применения более дешевых центробежных компрессоров. В результате стоимость аммиака упала более чем вдвое, произошло колоссальное увеличение его производства, а в связи с этим – увеличение производства пищевых продуктов, поскольку аммиак – ценное удобрение.
Обратимость химических процессов. Принцип Ле-Шателье
Реакции бывают обратимыми и необратимыми.
Необратимыми называют такие реакции, для которых не существует условий, при которых возможен обратный процесс.
Примером таких реакций могут служить реакции, которые происходят при скисании молока, или когда сгорела вкусная котлета. Как невозможно пропустить мясной фарш назад через мясорубку (и получить снова кусок мяса), также невозможно «реанимировать» котлету или сделать свежим молоко.
Но зададим себе простой вопрос: является ли необратимым процесс:
Для того чтобы ответить на этот вопрос, попробуем вспомнить, можно ли осуществить обратный процесс? Да! Разложение известняка (мела) с целью получить негашёную известь СаО используется в промышленном масштабе:
Таким образом реакция является обратимой, так как существуют условия, при которых с ощутимой скоростью протекают оба процесса:
Более того, существуют условия, при которых скорость прямой реакции равна скорости обратной реакции.
![]()
В этих условиях устанавливается химическое равновесие. В это время реакция не прекращается, но число полученных частиц равно числу разложившихся частиц. Поэтому в состоянии химического равновесия концентрации реагирующих частиц не изменяются. Например, для нашего процесса в момент химического равновесия
знак означает равновесная концентрация.
Возникает вопрос, что произойдёт с равновесием, если повысить или понизить температуру, изменить другие условия? Ответить на подобный вопрос можно, зная принцип Ле-Шателье:
если изменить условия (t, p, c), при которых система находится в состоянии равновесия, то равновесие сместится в сторону того процесса, который противодействует изменению.
Другими словами, равновесная система всегда противится любому воздействию извне, как противится воле родителей капризный ребёнок, который делает «всё наоборот».
Рассмотрим пример. Пусть установилось равновесие в реакции получения аммиака:
Вопросы. Одинаково ли число молей реагирующих газов до и после реакции? Если реакция идёт в замкнутом объёме, когда давление больше: до или после реакции?
Очевидно, что данный процесс происходит с уменьшением числа молекул газов, значит, давление в ходе прямой реакции уменьшается. В обратной реакции — наоборот, давление в смеси увеличивается.
Зададим себе вопрос, что произойдёт, если в этой системе повысить давление? По принципу Ле-Шателье пойдёт та реакция, которая «делает наоборот», т. е. понижает давление. Это — прямая реакция: меньше молекул газа — меньше давление.
Итак, при повышении давления равновесие смещается в сторону прямого процесса, где давление понижается, так как уменьшается число молекул газов.
Задание ЕГЭ. При повышении давления равновесие смещается вправо в системе:

Если в результате реакции число молекул газов не меняется, то изменение давления на положение равновесия не оказывает влияние.
Задание ЕГЭ. Изменение давления оказывает влияние на смещение равновесия в системе:
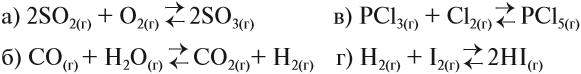
Положение равновесия этой и любой другой реакции зависит от концентрации реагирующих веществ: увеличивая концентрацию исходных веществ и уменьшая концентрацию полученных веществ, мы всегда смещаем равновесие в сторону прямой реакции (вправо).
Задание ЕГЭ. Химическое равновесие в системе
сместится влево при:
- повышении давления;
- понижении температуры;
- повышении концентрации СО;
- понижении концентрации СО.
Процесс синтеза аммиака экзотермичен, то есть сопровождается выделением теплоты, то есть повышением температуры в смеси.
Вопрос. Как сместится равновесие в этой системе при понижении температуры?
Рассуждая аналогично, делаем вывод: при понижении температуры равновесие сместится в сторону образования аммиака, так как в этой реакции теплота выделяется, а температура повышается.
Вопрос. Как изменится скорость химической реакции при понижении температуры?
Очевидно, что при понижении температуры резко понизится скорость обеих реакций, т. е. придётся очень долго ждать, когда же установится желаемое равновесие. Что делать? В этом случае необходим катализатор. Он хотя и не влияет на положение равновесия, но ускоряет наступление этого состояния.
Задание ЕГЭ. Химическое равновесие в системе
смещается в сторону образования продукта реакции при:
- повышении давления;
- повышении температуры;
- понижении давления;
- применении катализатора.

Энергетика.
Любая химическая реакция может протекать лишь при условии, что реагенты преодолеют энергетический барьер, а для этого они должны приобрести определенную энергию. Как мы уже говорили, каталитическая реакция X
Y состоит из ряда последовательных стадий. Для протекания каждой из них необходима энергия E
, называемая энергией активации. Изменение энергии вдоль координаты реакции представлено на рис. 1.
Рассмотрим сначала некаталитический, «тепловой» путь. Чтобы реакция смогла осуществиться, потенциальная энергия молекул X должна превысить энергетический барьер E
т. Каталитическая же реакция состоит из трех стадий. Первая – образование комплекса Х-Кат. (хемосорбция), энергия активации которой равна Е
адс. Вторая стадия – перегруппировка Х-Кат.
Y-Кат. с энергией активации Е
кат, и наконец, третья – десорбция с энергией активации Е
дес; Е
адс, Е
кат и Е
дес много меньше Е
т. Поскольку скорость реакции экспоненциально зависит от энергии активации, каталитическая реакция протекает значительно быстрее тепловой при данной температуре.
Катализатор можно уподобить инструктору-проводнику, который ведет альпинистов (реагирующие молекулы) через горный хребет. Он проводит одну группу через перевал и затем возвращается за следующей. Путь через перевал лежит значительно ниже того, который лежит через вершину (тепловой канал реакции), и группа совершает переход быстрее, чем без проводника (катализатора). Возможно даже, что самостоятельно группа вообще не смогла бы преодолеть хребет.
Кислотный катализ.
Каталитическая активность большого класса катализаторов обусловливается их кислотными свойствами. Согласно И.Брёнстеду и Т.Лоури, кислота – это соединение, способное отдавать протон. Сильные кислоты легко отдают свои протоны основаниям. Концепция кислотности получила дальнейшее развитие в работах Г.Льюиса, который дал определение кислоты как вещества, способного принимать электронную пару от вещества-донора с образованием ковалентной связи за счет обобществления этой электронной пары. Эти идеи вместе с представлениями о реакциях с образованием карбений-ионов помогли понять механизм разнообразных каталитических реакций, особенно тех, в которых участвуют углеводороды.
Силу кислоты можно определить с помощью набора оснований, изменяющих цвет при присоединении протона. Оказывается, некоторые промышленно важные катализаторы ведут себя как очень сильные кислоты. К ним относится катализатор процесса Фриделя – Крафтса, такой, как HCl-AlCl 2 O 3 (или HAlCl 4), и алюмосиликаты. Сила кислоты – это очень важная характеристика, поскольку от нее зависит скорость протонирования – ключевого этапа процесса кислотного катализа.
Активность таких катализаторов, как алюмосиликаты, применяющихся при крекинге нефти, определяется присутствием на их поверхности кислот Брёнстеда и Льюиса. Их структура аналогична структуре кремнезема (диоксида кремния), в котором часть атомов Si 4+ замещена атомами Al 3+ . Лишний отрицательный заряд, возникающий при этом, может быть нейтрализован соответствующими катионами. Если катионами являются протоны, то алюмосиликат ведет себя как кислота Брёнстеда:
Активность кислотных катализаторов обусловливается их способностью реагировать с углеводородами с образованием в качестве промежуточного продукта карбений-иона. Алкилкарбений-ионы содержат положительно заряженный углеродный атом, связанный с тремя алкильными группами и/или атомами водорода. Они играют важную роль как промежуточные продукты, образующиеся во многих реакциях с участием органических соединений. Механизм действия кислотных катализаторов можно проиллюстрировать на примере реакции изомеризации н
-бутана в изобутан в присутствии HCl-AlCl 3 или Pt-Cl-Al 2 O 3 . Сначала малое количество олефина С 4 Н 8 присоединяет положительно заряженный ион водорода кислотного катализатора с образованием третичного карбений-иона. Затем отрицательно заряженный гидрид-ион Н – отщепляется от н
-бутана с образованием изобутана и вторичного бутилкарбений-иона. Последний в результате перегруппировки превращается в третичный карбений-ион. Эта цепочка может продолжаться с отщеплением гидрид-иона от следующей молекулы н
-бутана и т.д.:
Существенно, что третичные карбений-ионы более стабильны, чем первичные или вторичные. Вследствие этого на поверхности катализатора присутствуют в основном именно они, а потому основным продуктом изомеризации бутана является изобутан.
Кислотные катализаторы широко применяются при переработке нефти – крекинге, алкилировании, полимеризации и изомеризации углеводородов . Установлен механизм действия карбений-ионов, играющих роль катализаторов в этих процессах. При этом они участвуют в целом ряде реакций, включая образование малых молекул путем расщепления больших, соединение молекул (олефина с олефином или олефина с изопарафином), структурную перегруппировку путем изомеризации, образование парафинов и ароматических углеводородов путем переноса водорода.
Одно из последних применений кислотного катализа в промышленности – получение этилированных топлив присоединением спиртов к изобутилену или изоамилену. Добавление кислородсодержащих соединений в бензин уменьшает концентрацию оксида углерода в выхлопных газах. Метил-трет
-бутиловый эфир (МТБЭ) с октановым числом смешения 109 тоже позволяет получить высокооктановое топливо, необходимое для работы автомобильного двигателя с высокой степенью сжатия, не прибегая к введению в бензин тетраэтилсвинца. Организовано также производство топлив с октановыми числами 102 и 111.